Comme le carbone, l'hydrogène et l'oxygène, l'azote est un élément indispensable aux organismes vivants. Il intervient dans la composition de nombreux matériaux nécessaires à la cellule : les amino-acides, qui constituent les protéines ; les bases puriques et pyrimidiques, qui codent l'information génétique dans les acides nucléiques (ADN et ARN) ; l'adénosine triphosphate ou ATP, qui emmagasine et cède l'énergie libérée ou consommée dans les réactions métaboliques, etc.
La plupart des végétaux trouvent l'azote qui leur est nécessaire dans le sol, sous forme d'ammoniac. L'agriculture tire parti de cette propriété en fournissant aux cultures des engrais azotés à base de sels d'ammoniac, ce qui provoque un accroissement sensible des rendements. En l'absence d'ammoniac dans le sol, certaines plantes peuvent fixer l'azote de l'atmosphère (l'air en contient près de 80 %) grâce à une bactérie qui parasite leurs racines.
L'ammoniac est donc une substance d'une extrême importance, et c'est par millions de tonnes que l'industrie chimique le produit chaque année. Le procédé de préparation le plus courant, mis au point en 1909 par les Allemands Fritz Haber et Carl Bosch, consiste à faire réagir l'azote extrait de l'air sur de l'hydrogène. Mais les deux gaz, pour se combiner en ammoniac NH3, doivent être portés à haute température (plus de 500 °C) et soumis à des pressions égales à 200 ou 300 fois la pression atmosphérique : c'est là un inconvénient coûteux du procédé Haber.
Le procédé de Van Tamelen mime par certains aspects le processus biologique de fixation de l'azote utilisé par certains micro-organismes : il se déroule dans les conditions ordinaires de température et de pression, et il emploie un réactif catalytique, c'est-à-dire une substance qui est retrouvée intacte lorsque l'opération est terminée.
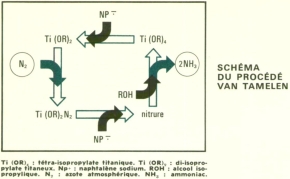
Quatre réactions
Ce réactif est un complexe organique du titane, le tétra-isopropylate titanique, dissous dans un solvant éthéré exempt de toute trace d'eau. Sous l'action d'un réducteur comme le naphtalène sodium, le tétra-isopropylate se transforme en di-isopropylate titaneux, dont chaque molécule peut fixer une molécule d'azote. Le complexe azote-di-isopropylate, Ti(OR)2N2, soumis à l'action du naphtalène sodium, puis de l'alcool isopropylique, fournit deux molécules d'ammoniac avec un bon rendement (65 % en moyenne). Dans le même temps, la molécule de tétra-isopropylate est régénérée, fermant ainsi la boucle. Le cycle des quatre réactions peut théoriquement être répété indéfiniment.
La production d'ammoniac, dans ce processus, n'est possible qu'à cause des propriétés chimiques exceptionnelles du complexe Ti(OR)2N2. L'azote combiné dans cette molécule est, en effet, susceptible d'être réduit à l'état d'ammoniac.
Autre particularité pleine de promesses : si l'on remplace l'azote pur par de l'air, la conversion azote-ammoniac continue à se produire, malgré la présence d'oxygène.
Physique
Les accélérateurs à venir
La 14e Conférence internationale sur la physique des hautes énergies, qui s'est tenue à Vienne du 28 août au 5 septembre 1968, n'a pas enregistré de communications à caractère sensationnel (comme ce fut le cas des deux précédentes conférences). Mais elle a confronté les résultats — parfois contradictoires — des expériences les plus récentes et examiné les modèles mathématiques proposés tant pour décrire les phénomènes observés que pour prévoir ceux qui pourront l'être à l'avenir.
Quatre interactions
On sait que les interactions connues dans la nature se répartissent actuellement en quatre catégories :
– les interactions gravitationnelles : sensibles pour les grandes masses (comme les astres, par exemple), elles sont négligeables à l'échelle des particules ;
– les interactions fortes, qui assurent la cohésion du noyau atomique ;
– les interactions électromagnétiques, qui interviennent entre particules chargées ;
– les interactions faibles, ainsi nommées parce qu'elles se produisent lentement. Elles interviennent dans les désintégrations radio-actives.




