océan (suite)
Une substance vitale
L’eau de mer est un complexe chimique où sont représentées toutes les substances connues, en particulier celles qui sont nécessaires à l’entretien des phénomènes vitaux. C’est donc un véritable « liquide physiologique », où la vie terrestre est apparue. Cette richesse se manifeste sous quatre formes essentielles.
• La salinité*. Elle s’exprime en grammes par litre (ou en kg/m3), c’est-à-dire en millièmes. Elle provient de la mise en solution d’un très grand nombre de corps, parmi lesquels le chlore et le sodium, associés en chlorure de sodium, sont prépondérants (fig. 3). Tous les composants dilués conservent entre eux des rapports sensiblement constants, à tel point qu’il suffit de doser la chlorinité (ou teneur en chlore) pour obtenir la salinité. La plus grande partie de l’océan a une salinité comprise entre 33 et 37 p. 1 000. Sous les hautes latitudes, elle peut descendre au-dessous de 30, et dépasser 37 dans les régions tropicales ; dans les zones équatoriales et tempérées où les pluies sont abondantes, elle se situe aux environs de 35 p. 1 000. Comme il est normal, c’est dans les mers qu’on trouve les écarts les plus grands par rapport à la moyenne : on distingue les bassins de dilution, bien alimentés en eau douce (exemple, la Baltique) et dont les eaux sortent par un courant de surface, et les bassins de concentration, au fort déficit hydrologique (exemple, la mer Rouge), où le courant de sortie s’écoule sur le fond (v. courants océaniques). Au-dessous d’une surface de discontinuité, ou halocline, immergée au voisinage de la thermocline, la salinité est répartie de façon plus équitable et oscille autour de 35 p. 1 000.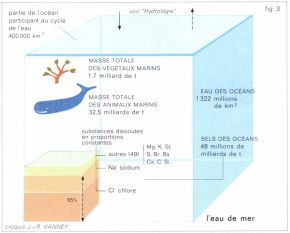
• L’oxygénation. En raison de ses contacts intimes avec l’atmosphère, l’eau de mer en contient tous les gaz ; la plupart sont d’ailleurs inertes, et leur dosage ne présente qu’un intérêt relatif. Parmi les gaz dissous actifs, le plus important est l’oxygène, surtout présent en surface où il sert à l’entretien de la photosynthèse. Comme sa teneur décroît au fur et à mesure que l’eau s’échauffe, on le trouve plus abondant dans les régions polaires que dans les régions tropicales. Il est diffusé jusqu’aux plus grandes profondeurs par les courants et est parfois utilisé pour en déterminer les parcours. Toutefois, il se raréfie au niveau des courants intermédiaires, où le matériel organique en suspension est important (c’est la couche dite « du minimum d’oxygène ») ; dans les régions que n’atteignent pas (ou atteignent mal) les brassages, l’oxygène est peu à peu remplacé par l’autre gaz actif, l’hydrogène sulfuré. Seules les bactéries peuvent se maintenir dans ces milieux en voie d’asphyxie. Lorsque le confinement est extrême, ces « eaux mortes » sont dites « euxiniques ».
En conséquence, des teneurs élevées en oxygène ou en hydrogène sulfuré traduisent l’importance des brassages ou la stagnation des eaux et la possibilité plus ou moins grande offerte au développement de la vie.
• L’alcalinité. L’eau de mer est une solution d’électrolytes dissociables en ions qui contribuent au maintien de l’équilibre en H+ et OH–. La concentration en ions H+ amène une augmentation de l’acidité de l’eau de mer (le pH tombe à 7 et en dessous). C’est notamment ce qui se produit lors : d’un abaissement de la température permanent (pôles) ou saisonnier ; d’une abondante arrivée d’eau douce (crue dans un estuaire) ; d’une réduction de l’activité chlorophyllienne, augmentation de la teneur en CO2 non consommé, comme on l’a constaté la nuit sur certains rivages.
En dehors de ces cas, le plus souvent littoraux et donc fortement influencés par l’hydrologie continentale, l’eau de mer présente généralement une concentration en ions OH– : c’est une solution alcaline avec des pH compris entre 7,6 et 8,4. On en connaît encore très mal les variations dans le temps et l’espace ; ce qui est sûr, c’est qu’elles sont l’inverse de celles du CO2, qui se combine très vite sous forme de carbonate et de bicarbonate. La connaissance du pH est importante pour comprendre le modelé des calcaires littoraux.
• La fertilité. L’eau de mer contient en suspension des particules minérales et organiques qui lui donnent sa couleur, une certaine transparence et une fertilité plus ou moins grande. Celle-ci est proportionnelle à l’importance des substances utilisées par la photosynthèse, surtout l’azote sous la forme libre ou combinée en sels nutritifs (nitrates, phosphates, silicates) directement assimilables par le phytoplancton. En surface, la teneur en sels nutritifs est fort variable selon la durée et l’intensité de l’éclairement, et donc de la photosynthèse. Sous cet étage euphotique, les sels tendent à se concentrer, car ils sont inutilisés (étages disphotique, puis aphotique) et augmentés par décomposition bactérienne des déchets venus de la surface. De cette concentration en minéraux nutritifs découle l’importance des oscillations verticales de la thermocline (divergence, upwelling, v. courants océaniques) qui réalimentent la couche de surface en substances vitales. Dosages des sels et recherches de ces remontées fertilisantes sont deux préoccupations de l’océanographie biologique.
Grâce à ces divers facteurs, la vie a pu prendre naissance dans les océans en formant, maillon après maillon, une chaîne vitale (ou alimentaire) allant de l’organisme microscopique (comme la bactérie) jusqu’au plus volumineux mammifère (comme la baleine). L’essentiel de la vie terrestre s’y concentre sous la double forme benthique (fixée ou libre) et pélagique (dérivant ou vivant en pleine eau), jusque dans les plus grandes fosses.

Une liqueur dense
L’eau de mer est la plus lourde des eaux de l’hydrosphère. Devant une embouchure, elle se mélange ou, mieux, plonge sous l’eau douce qui en sort. Cette dernière a une densité égale à 1 (à + 4 °C) ; celle de l’eau de mer oscille entre 1,02 et 1,03. L’étroitesse de cette « fourchette » oblige à pousser la précision jusqu’à la cinquième décimale : dans l’Atlantique tempéré, la densité est de 1,028 00. Étant donné que les deux premiers chiffres (l’unité et la première décimale) sont toujours les mêmes, en pratique on ne retient que les suivants en déplaçant la virgule après le chiffre des millièmes. La densité alors exprimée par le symbole σt est donc égale à (d – 1) × 1 000.
L’eau de mer est d’autant plus dense que : la quantité de sels dissous est plus grande (la température restant constante) ; la température est plus basse (la salinité restant égale) ; la pression est plus élevée (cas des grandes profondeurs) ; le volume des particules en suspension est plus grand (comme dans le cas des courants de turbidité).




