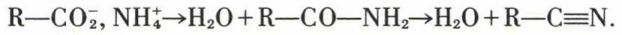Composés non rencontrés à l’état naturel et caractérisés par la présence, dans leur formule, du groupe  écrit conventionnellement —NO2. La nomenclature les désigne du nom de l’hydrocarbure correspondant précédé de nitro :
écrit conventionnellement —NO2. La nomenclature les désigne du nom de l’hydrocarbure correspondant précédé de nitro :
C6H5NO2 = nitrobenzène ; CH3—CH(NO2)—CH3 = nitro-2 propane.
En principe, les dérivés nitrés peuvent se préparer par action de l’acide nitrique sur les hydrocarbures : RH + NO3H → H2O + R—NO2 (nitration) ; mais les modalités varient avec la nature de l’hydrocarbure. Le méthane est nitré par l’acide nitrique, le plus anhydre possible, en phase gazeuse ; les alcanes moyens, par ébullition avec l’acide nitrique assez concentré ; les carbures aromatiques, par l’acide nitrique fumant ou le mélange sulfonitrique vers 0 °C. La nitration se répète facilement dans le cas du méthane ou des carbures benzéniques, conduisant à des polynitrés.
Seuls les dérivés nitrés aliphatiques peuvent s’obtenir par la réaction d’échange

Les dérivés nitrés sont associés par interaction de dipôle, ce qui les rend peu volatils dès le premier terme, le nitrométhane CH3—NO2, qui bout à 100 °C ; seuls les tout premiers termes sont solubles dans l’eau. Les dérivés nitrés sont relativement stables thermiquement, mais, leur décomposition étant exothermique, les termes simples et les dérivés polynitrés deviennent explosifs, soit par élévation brusque de la température, soit sous l’influence d’un détonateur. Seuls les dérivés trinitrés des noyaux aromatiques constituent pratiquement des explosifs ; c’est en particulier le cas du trinitrotoluène (T. N. T. ou tolite) :

Notons que quelques représentants de ces carbures benzéniques trinitrés ont une odeur puissante ; ils constituent les « muscs nitrés ».
Tous les dérivés nitrés R—NO2, ArNO2 sont réductibles, soit par voie catalytique (Ni), soit par voie chimique (Fe + HCl), en amines primaires R—NH2 ou Ar—NH2. La réduction du nitrobenzène est la seule préparation pratique de l’aniline C6H5—NH2.
Toutefois, le nitrobenzène peut subir des réductions partielles, dont les intermédiaires, avant l’aniline, sont la phénylhydroxylamine C6H5—NHOH (isomérisable en para-aminophénol), l’azoxybenzène C6H5—NO=N—C6H5, l’azobenzène C6H5—N=N—C6H5, l’hydrazobenzène C6H5—NH—NH—C6H5, isomérisable en benzidine ; les réductions intermédiaires, génératrices de para-amino-phénol et de benzidine, ont un intérêt pratique.
Les dérivés nitrés aliphatiques sur un carbone non tertiaire sont caractérisés par une grande mobilité des hydrogènes liés à ce carbone. Les halogènes s’y substituent très facilement :
CH3—NO2 + 3 Cl2 → 3 HCl + Cl3 CNO2 (chloropicrine).
L’acide nitreux remplace l’hydrogène par NO :

Si R′ = H, le nitrol est soluble en rouge dans les alcalis :

Mais la manifestation la plus importante de cette mobilité de l’hydrogène est l’addition des dérivés carbonylés en milieu alcalin :

Ces alcools nitrés sont réductibles en amino-alcools, d’où un accès facile à des alcaloïdes artificiels employés en pharmacie.
Dans le cas du nitrométhane et de l’aldéhyde formique, l’addition se répète deux fois :
3 HCHO + CH3—NO2 → (CH2OH)3C—NO2.
L’éther trinitrique de ce triol nitré est un puissant explosif, supérieur à la nitroglycérine.
C. P.





 écrit conventionnellement —NO2. La nomenclature les désigne du nom de l’hydrocarbure correspondant précédé de nitro :
écrit conventionnellement —NO2. La nomenclature les désigne du nom de l’hydrocarbure correspondant précédé de nitro :