hétérocycliques (noyaux) (suite)
Mais il apparaît deux propriétés nouvelles :
a) une substitution nucléophile en α (avec un peu de γ) :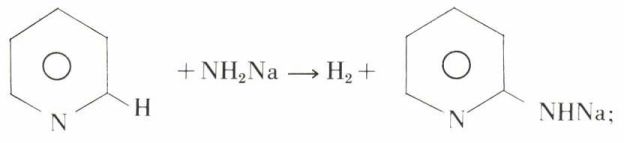
b) une faible basicité de l’azote 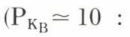
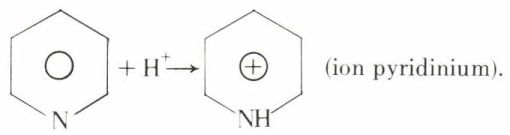
Cet azote additionne les éthers halohydriques, formant des halogénures quaternaires que la chaleur isomérise en halogénures de pyridinium α-alcoylés :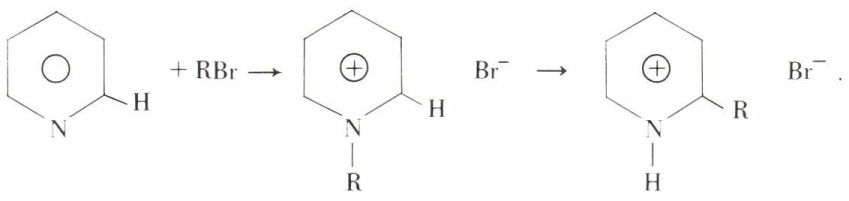
AgOH transforme les halogénures quaternaires en bases quaternaires, oxydables en α-pyridones :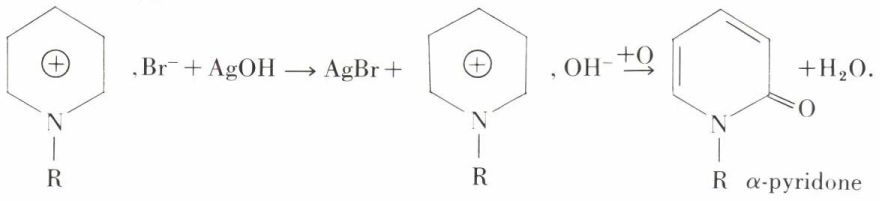
Les fonctions portées par le carbone en β de l’azote ressemblent aux fonctions portées par le noyau benzénique, mais, portées par le carbone en α (ou en γ), elles sont particulières, et c’est ainsi que la pyridine γ-hydroxylée n’existe pas sous cette forme, mais sous la forme γ-pyridone :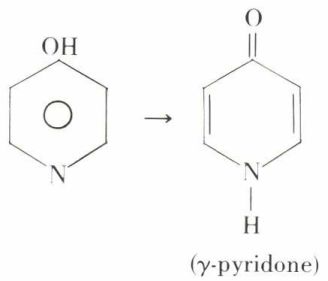
Les chaînes latérales en β ont mêmes propriétés qu’en série benzéique.
La β-picoline ressemble au toluène. Les trois picolines :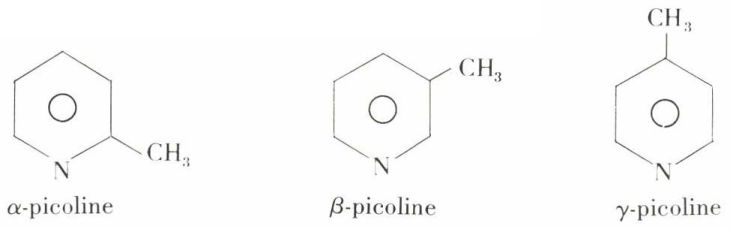
s’oxydent (KMnO4, HNO3) en acides pyridine-carboxyliques correspondants. Mais, dans l’α ou la γ-picoline, les H de CH3 ont une mobilité comparable à celle des hydrogènes de CH3 des cétones méthylées :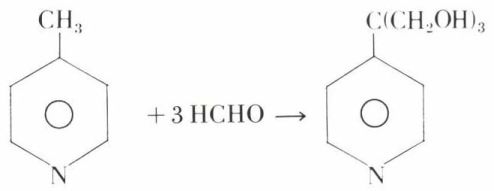
Ion pyrilium
Les sels de pyrilium se forment dans l’oxydation, en milieu acide, des dicétones-δ :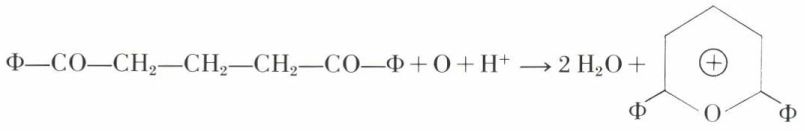
Ces sels sont remarquablement cristallisés ; l’ammoniac les transforme en sels de pyridinium.
Deux benzopyridines, la quinoléine et l’isoquinoléine, et une dibenzopyridine, l’acridine, existent dans le goudron de houille :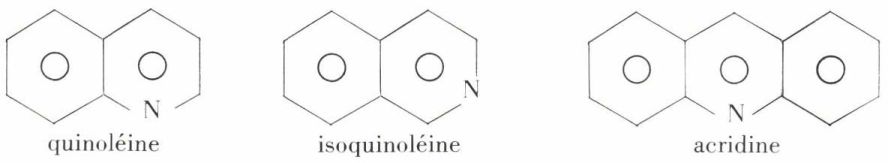
À ces hétérocycles se rattachent divers alcaloïdes et divers colorants.
Généralités sur la genèse des hétérocycles pentagonaux
Les trois hétérocycles fondamentaux présentent une parenté ; sans qu’il s’agisse de transformations rémunératrices, on peut passer de l’un à l’autre ; le furanne et l’ammoniac vers 500 °C forment des traces de pyrrole.
Tous trois sont accessibles à partir des dicétones-γ, le cycle furannique par simple déshydratation, le cycle thiofénique sous l’action de P2S5, le cycle pyrrolique sous l’action d’une aminé primaire.
Tous trois peuvent se préparer à partir de l’acide mucique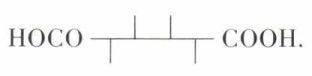
La pyrogénation de l’acide conduit, après décarboxylation d’un intermédiaire, l’acide furoïque (ou pyromucique), au furanne :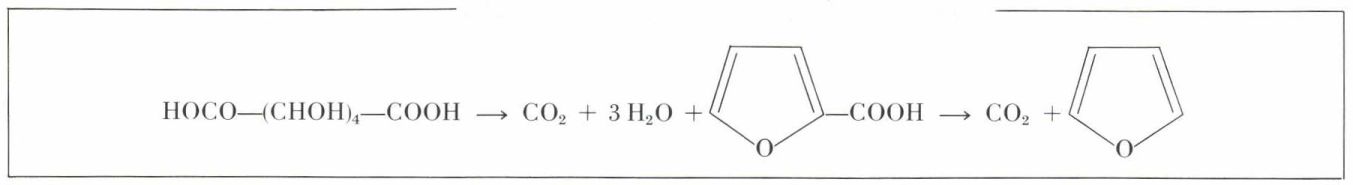
En présence de sulfure de baryum, on arrive au thiofène, et la pyrogénation du mucate d’ammonium conduit au pyrrole.
Furanne
Le furanne est présent dans le goudron de sapin ; on le prépare généralement à partir du furfural (aldéhyde furoïque) oxydé en acide furoïque qui est décarboxylé.
C’est un liquide d’odeur chloroformique, bouillant à 33 °C et insoluble dans l’eau. Il est thermiquement stable, mais les acides concentrés le polymérisent rapidement en une résine amorphe. Cette sensibilité aux acides masque la plupart des substitutions électrophiles qu’on en pourrait attendre ; celles-ci : halogénation, nitration, réaction de Friedel et Crafts, nécessitent des précautions particulières.
Le furanne est nettement moins saturé que le benzène ; il peut être hydrogéné chimiquement en dihydrofuranne, et, catalytiquement, en tétrahydrofuranne. Il présente donc, atténuées, quelques propriétés des diènes conjugués ; en particulier, il s’additionne à l’anhydride maléique.
Il s’oxyde en acide maléique, puis en acide oxalique.
Un dérivé très important est l’aldéhyde furoïque (ou pyromucique), généralement appelé furfural :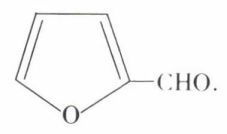
Celui-ci résulte de l’hydrolyse des « pseudo-celluloses », appelées xylanes. Cette hydrolyse libère le D-xylose
que HCl dilué et bouillant déshydrate en furfural.
Le furfural ressemble étroitement au benzaldéhyde ; comme lui, il subit la réaction de Cannizzaro, la réduction duplicative, la benzoïnation, les condensations avec les anilines N-bisubstituées.
L’hydrogénation catalytique le transforme en alcool tétrahydrofurylique, dés-hydratable en α-dihydropyranne :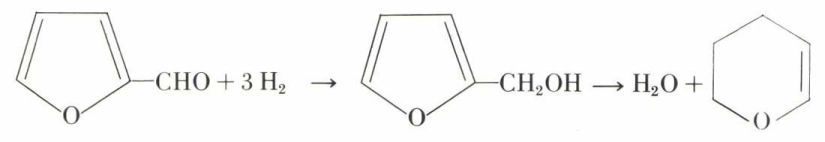
L’acide furoïque (ou pyromucique) rappelle tout à fait l’acide benzoïque.
Thiofène
Présent entre 0,5 et 4 p. 100 dans le benzène commercial, le thiofène en était autrefois extrait ; on le prépare industriellement par passage de l’acétylène à 600 °C sur la pyrite :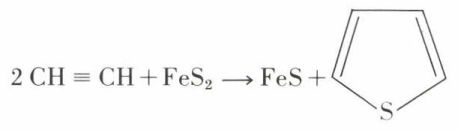
C’est un liquide bouillant à 84 °C et pratiquement inséparable du benzène par voie physique.
C’est, de tous les hétérocycles pentagonaux, celui qui ressemble le plus au benzène. Thermiquement stable, il se prête facilement aux substitutions électrophiles (halogénation, sulfonation, réactions de Friedel et Crafts) ; sous cet aspect, il est plus actif que le benzène, et la sulfonation sélective du benzène commercial a servi à son extraction.
Poison des catalyseurs, il ne peut être hydrogéné.
L’acide nitrique bouillant ouvre le cycle, formant d’une part l’acide maléique HOCO—CH=CH—COOH, d’autre part l’acide sulfurique.
Pyrrole
Le pyrrole est le plus important des noyaux pentagonaux. On l’a longtemps extrait de l’huile de Dippel en utilisant son caractère légèrement acide. C’est un liquide associé par liaison hydrogène, bouillant à 131 °C, et insoluble dans l’eau.
Un peu moins que le furanne, il est sensible aux acides concentrés, qui le polymérisent. Il peut, néanmoins, être halogène 4 fois sur le noyau, même par l’iode.
Bien qu’azoté, il n’est pas basique, car le doublet non liant de l’azote est engagé dans le sextet aromatique. Par contre, il est légèrement acide et fournit, en présence de potasse sèche, un dérivé potassé.
Ce dernier peut être alcoylé :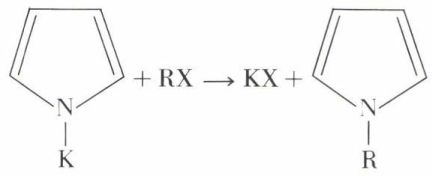
À des températures variables selon la nature de R, ces pyrroles N-alcoylés se transforment en α-alcoypyrroles :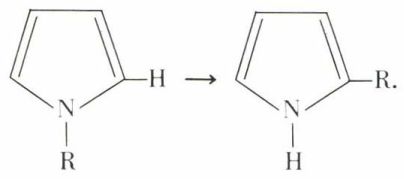
Il y a là une analogie étroite avec le phénol. Le pyrrole décompose les organomagnésiens, et, par fixation du gaz carbonique sur le dérivé métallique, on aboutit à l’acide pyrrole α-carboxylique :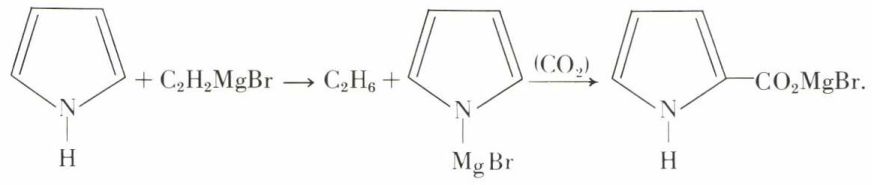
Comme le phénol, le pyrrole subit la réaction de Reimer et Tiemann :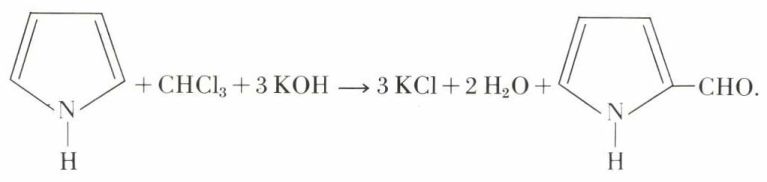
Comme le phénol, il copule avec les diazoïques.
Le pyrrole possède quelques propriétés diéniques ; il peut être hydrogéné au sodium en pyrroline, et, catalytiquement, en pyrrolidine :
Contrairement au pyrrole, la pyrroline et la pyrrolidine sont des bases assez fortes.
Les cycles polypyrroliques (prophyrines) constituent les pigments sanguin et chlorophyllien, et l’importance biologique des pyrroles substitués est très grande.




