étain (suite)
Principaux composés
Les composés de l’étain sont rattachés à deux nombres d’oxydation, respectivement II (dérivés stanneux) et IV (dérivés stanniques).
Dérivés stanneux
Le potentiel normal d’oxydoréduction du couple formé en solution aqueuse par les ions stanneux et les ions stanniques simples est de 0,15 volt et correspond à la transformation
Sn2+ ⇄ Sn4+ + 2 e–.
Cette faible valeur entraîne le fait que les sels stanneux sont des réducteurs énergiques. Ainsi, le chlorure stanneux réduit les sels ferriques à l’état ferreux en solution aqueuse.
L’hydroxyde stanneux est amphotère ; en milieu acide, on a :
Sn(OH)2 ⇄ Sn2+ + 2 OH–,
et en milieu basique :
Sn(OH)2 + OH– ⇄ Sn(OH)3–,
qui donne des stannites tels que Na[Sn(OH)3] ou Ba[Sn(OH)3–]2. On connaît aussi des complexes stanneux tels que M1SnCl3, et 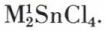
Dérivés stanniques
On connaît l’hydrure SnH4, l’oxyde SnO2 (déjà signalé comme minerai), des halogénures tels que SnCl4 ou SnF4, des sels halogénés complexes, tel K2SnF6 (fluorostannate isomorphe du fluorosilicate de potassium), organostanniques R4Sn, R3SnX, R2SnX2, RSnX3 (où R est un radical hydrocarboné et X un halogène). L’oxyde est amphotère, mais plus acide que basique, les sels stanniques sont fortement hydrolysés ; d’autre part, SnO2 s’unit à chaud à des oxydes basiques en donnant des stannates comme Mg2SnO4. On connaît aussi des sels, tel K2[Sn(OH)6], d’un « acide stannique ». Un ammonostannate K2Sn(NH2)6 s’obtient par la réaction Snl4 + 6 KNH2 → K2Sn(NH2)6, 2 KI.
L’étain est utilisé dans divers alliages et pour protéger certains métaux en les recouvrant : fer-blanc, cuivre étamé.
H. B.
Minerais
Rarement à l’état natif, tel qu’on le rencontre en faibles quantités en Bohême, au Nigeria ou en Nouvelle-Galles du Sud, l’étain est extrait de la cassitérite, bioxyde SnO2, dont la teneur en métal est en général inférieure à 4 p. 100.
Le minerai le plus couramment exploité se présente sous la forme de gisements d’alluvions (Malaisie, Thaïlande, Chine, U. R. S. S.) ; les terres contenant le minera sont abattues au jet d’eau sous pression et concentrées par lavage à travers de longs couloirs métalliques (sluices). Sous forme de filons dans le granit, la cassitérite contient des impuretés plus difficiles à éliminer telles que le fer, le manganèse et le tungstène (Cornouailles), ce qui nécessite des opérations plus nombreuses d’enrichissement du minerai par broyage, triage hydromécanique, flottation et séparation magnétique.
Élaboration du métal
Après grillage et lavage par une solution acide (lixiviation), la cassitérite est débarrassée de la majeure partie de ses impuretés — et sa teneur en étain atteint 50 à 60 p. 100 —, mais elle contient encore de l’oxyde de fer. Le principe de cette métallurgie est la réduction du bioxyde par le carbone à haute température, entre 800 et 1 300 °C, ce qui oblige à certaines précautions pour limiter les pertes de métal par volatilisation.
Lorsque la réduction est pratiquée au four électrique, qui remplace progressivement le four à réverbère, on traite une charge agglomérée de minerai, coke et fondant. L’opération est conduite en plusieurs étapes.
• Le premier traitement permet d’obtenir l’étain fondu sur la sole du four, recouvert d’une scorie solide contenant du fer et 10 à 15 p. 100 d’étain, laquelle est récupérée.
• Un second traitement, également au four électrique, d’une charge de scorie précédente, coke, chaux et ferrosilicium, permet de récupérer l’étain fondu dans la couche inférieure sur la sole du four ; cette couche est recouverte par une couche de ferrosilicium, que l’on récupère, et la troisième couche supérieure est constituée par la scorie épuisée.
L’étain ainsi obtenu doit être affiné soit par liquation, soit par traitement d’oxydation (perchage), ou encore par filtration. Dans ce dernier procédé, on favorise la formation d’un composé fer-étain, qui est séparé de l’étain fondu, ce qui permet d’abaisser la teneur en fer de 0,5 à 0,03 p. 100.
Dans les pays pauvres en minerai (France), une quantité notable de métal provient du traitement des déchets de fer-blanc, mais cette récupération devient moins intéressante par suite du développement du fer-blanc avec étamage électrolytique. Les déchets sont traités soit par électrolyse, soit par un courant de chlore. On récupère ainsi du métal pur, qui est utilisé en fonderie, ou du chlorure stanneux, employé en teinturerie.
Utilisation du métal pur
L’étain — massif ou en recouvrement sur d’autres métaux — est principalement utilisé en raison de sa résistance à la corrosion atmosphérique et à l’action de nombreux produits chimiques, minéraux ou organiques. De plus, les sels d’étain courants n’étant pas toxiques, l’emploi de ce métal s’est développé dans l’industrie alimentaire (vaisselle, appareillages, canalisations, conserves) et l’industrie pharmaceutique (récipients, tubes de conditionnement).
Le cuivre et surtout le fer dit « fer-blanc » sont protégés par une mince couche d’étain pur.
Depuis longtemps, l’étamage du fer est pratiqué par un procédé thermique : la pièce ferreuse, dont la surface subit un nettoyage et un décapage préalables, est immergée dans un bain d’étain fondu ; ce « fer-blanc au trempé » a une épaisseur d’étain de 0,05 à 0,10 mm. À partir de 1940, principalement aux États-Unis, pour des raisons d’économie de métal et de fabrication en continu, l’étamage électrolytique s’est développé pour l’obtention de tôles et de feuillards d’acier extra-doux étamé et, pour ces produits, a supplanté l’ancien procédé d’étamage à chaud au trempé. La mince couche d’étain n’a qu’une épaisseur de 0,001 à 0,02 mm ; pour certaines utilisations, en particulier les boîtes de conserves, on applique un vernis afin d’obturer les porosités de la couche d’étain et de garantir ainsi une bonne tenue aux produits alimentaires.
L’étamage des fils de cuivre conducteurs facilite leur soudage et les protège de l’altération par les produits sulfurés du caoutchouc isolant.




