cinétique chimique (suite)
Vitesse de réaction, définition et mesure
On définit pour la réaction
m1A1 + m2A2 + ... → m′1A′1 + m′2A′2 + ...
la vitesse à un instant donné : soient n1, n2, ..., n′1, n′2 ... les nombres de moles respectifs de A1, A2 ... A′1, A′2 ... présents dans le mélange au temps t et dn1, dn2 ... dn′1, dn′2 ... leurs accroissements (algébriques) au temps t + dt ; ceux-ci ne sont pas indépendants, car il résulte de l’équation de la réaction que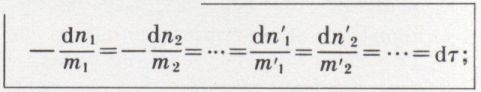
la valeur commune de ces rapports est la variation dτ du degré d’avancement τ de la réaction 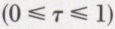 et permet de définir la vitesse de la réaction à l’instant t par l’expression
et permet de définir la vitesse de la réaction à l’instant t par l’expression 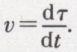 Le mélange des réactifs et des produits peut être, suivant les cas, hétérogène ou homogène ; dans ce dernier cas, d’étude plus facile, chacun des corps — A1 par exemple — est à chaque instant caractérisé par sa molarité :
Le mélange des réactifs et des produits peut être, suivant les cas, hétérogène ou homogène ; dans ce dernier cas, d’étude plus facile, chacun des corps — A1 par exemple — est à chaque instant caractérisé par sa molarité : 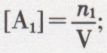 si le volume V du mélange est constant au cours du temps, la vitesse de la réaction est représentée, à un facteur constant près, par
si le volume V du mélange est constant au cours du temps, la vitesse de la réaction est représentée, à un facteur constant près, par  par exemple.
par exemple.
Mesurer la vitesse d’une réaction homogène revient, dès lors, à suivre au cours du temps la variation de la molarité de l’un quelconque des corps du mélange. On dispose pour cela de deux sortes de méthodes.
• Méthodes chimiques. Sur un prélèvement fait à l’instant t on dose rapidement l’un des constituants du mélange ; l’erreur, due à la durée nécessaire du dosage et au fait que celui-ci ne peut toujours avoir lieu dans les conditions mêmes où se poursuit la réaction, risque d’être importante, et ces méthodes ne sont applicables qu’aux réactions très lentes ; c’est ainsi que Berthelot* et Péan de Saint-Gilles, étudiant l’estérification de l’alcool, effectuaient à intervalles réguliers des dosages d’acide acétique.
• Méthodes physiques. La composition du mélange est déduite à chaque instant de la mesure d’une propriété physique : indice de réfraction, spectre d’absorption, pouvoir rotatoire, conductivité électrique, etc. (et, dans le cas d’un mélange gazeux et d’une réaction qui modifie le nombre des molécules par la densité [si la pression est maintenue constante] et la pression [à volume constant]) ; ces méthodes physiques n’apportent, en général, qu’une perturbation négligeable à la marche de la réaction, et les mesures sont souvent très rapides ; ces méthodes doivent être préférées aux méthodes chimiques.
Les mesures de vitesse des réactions homogènes ont montré que celles-ci dépendent de plusieurs facteurs, dont les plus importants sont les molarités des réactifs (et parfois aussi celles des corps produits) et la température ; certaines réactions sont sensibles à l’action de radiations électromagnétiques ; les catalyseurs, enfin, interviennent pour accroître par leur présence la vitesse d’un grand nombre de réactions (v. catalyse).
Influence des molarités
Il est très fréquent que la vitesse d’une réaction homogène, d’équation
m1A1 + m2A2 + ... → m′1A′1 + m′2A′2 + ...,
soit bien représentée par une expression de la forme 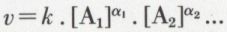
[A1], [A2], ... sont les molarités des seuls réactifs, c’est-à-dire des corps figurant au premier membre de l’équation de la réaction ; chaque molarité étant affectée d’un exposant, α1, α2, ... dénommé ordre partiel vis-à-vis du constituant considéré ; la somme α1 + α2 + ... étant l’ordre global de la réaction. Chaque ordre partiel est déterminé expérimentalement par des mesures de vitesse effectuées alors que les molarités des autres réactifs sont maintenues constantes. Un ordre partiel peut être nul : dans ce cas, la vitesse est indépendante de la molarité du réactif ; il est souvent égal à un, parfois à deux, et, plus rarement, il peut être demi-entier ; ainsi, pour la réaction entre gaz 2 NO + 2 H2 → N2 + 2 H2O, on a v = k . [NO]2 . [H2]. La réaction est du deuxième ordre par rapport à NO, c’est-à-dire que sa vitesse est proportionnelle au carré de la molarité (ou de la pression partielle) de NO ; elle est seulement du premier ordre par rapport à H2.
Remarque. Les ordres partiels peuvent être, de façon générale, différents des coefficients de l’équation, l’exemple précédent le montrant pour H2 ; c’est seulement dans quelques cas particuliers que cette égalité est réalisée ; par exemple, la vitesse de formation de l’iodure d’hydrogène suivant I2 + H2 → 2 HI est de la forme v = k . [I2] . [H2] ; de telles réactions sont dites « simples ». Pour certaines réactions, cependant, la loi expérimentale de vitesse n’est pas de la forme précédente ; telle est la synthèse du bromure d’hydrogène suivant H2 + Br2 → 2 HBr, pour laquelle Bodenstein a trouvé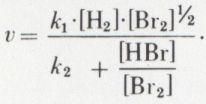
On dit d’une telle réaction qu’elle n’admet aucun ordre.
Influence de la température
Une élévation de température accroît de façon très générale la vitesse des réactions, et cela de manière importante ; ainsi, l’estérification de l’alcool, qui demande plusieurs mois à température ordinaire, s’effectue en quelques heures à 100 °C, en quelques minutes à 180 °C. Dans l’expression de la vitesse d’une réaction 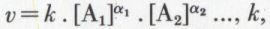 coefficient de vitesse, est une fonction rapidement croissante de la température absolue T, suivant la loi exponentielle d’Arrhenius*
coefficient de vitesse, est une fonction rapidement croissante de la température absolue T, suivant la loi exponentielle d’Arrhenius* 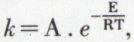 où e est la base des logarithmes népériens, E l’énergie d’activation et A le facteur de fréquence de la réaction considérée. Il n’est pas rare de voir la vitesse d’une réaction doubler quand la température s’élève de 10 °C au-dessus de la température ordinaire ; dans ce cas, l’énergie d’activation est d’environ 13 kcal par mole. Cette action de la température a des conséquences pratiques importantes ; ainsi, le temps de cuisson des aliments est fortement diminué si l’on opère sous pression de 2 atmosphères par exemple, et cela par suite de l’élévation de 20 °C de la température d’ébullition de l’eau.
où e est la base des logarithmes népériens, E l’énergie d’activation et A le facteur de fréquence de la réaction considérée. Il n’est pas rare de voir la vitesse d’une réaction doubler quand la température s’élève de 10 °C au-dessus de la température ordinaire ; dans ce cas, l’énergie d’activation est d’environ 13 kcal par mole. Cette action de la température a des conséquences pratiques importantes ; ainsi, le temps de cuisson des aliments est fortement diminué si l’on opère sous pression de 2 atmosphères par exemple, et cela par suite de l’élévation de 20 °C de la température d’ébullition de l’eau.
Réactions photochimiques
Certaines réactions sont sensibles aux radiations, en particulier à la lumière ; c’est ainsi qu’un mélange d’hydrogène et de chlore, qui, à la température ordinaire, ne réagit pas à l’obscurité, se transforme peu à peu en chlorure d’hydrogène s’il est éclairé et fait même explosion s’il est frappé directement par les rayons du soleil ; de même, les plantes à chlorophylle absorbent, pendant le jour seulement, le gaz carbonique de l’atmosphère. La lumière n’agit qu’à condition d’être absorbée (loi de Grotthus), mais, alors que, dans la synthèse de HCl, réaction exothermique, son action est comparable à celle d’une amorce, elle apporte dans le cas de la photosynthèse l’énergie nécessaire à la réaction endothermique ; le rendement quantique, nombre de molécules transformées par photon absorbé, qui est de plusieurs milliers dans le premier cas, est très inférieur à un dans le second ; ces exemples sont en effet, comme beaucoup d’autres, en désaccord avec la loi d’équivalence photochimique d’Einstein, d’après laquelle il y aurait autant de molécules transformées que de photons absorbés.




