cinétique chimique (suite)
Mécanisme des réactions
La cinétique chimique ne se borne pas à la mesure systématique des vitesses de réaction et à l’établissement des lois de vitesse qui découlent de ces mesures ; un programme beaucoup plus ambitieux est de chercher à déterminer comment les réactions s’effectuent à l’échelle moléculaire individuelle. L’équation de la réaction n’est, en effet, qu’un bilan qui met en présence l’état initial du mélange des réactifs et l’état final des produits ; l’équation établit entre réactifs et produits des rapports massiques, mais ne renseigne nullement sur le détail de l’évolution qui conduit le système des réactifs aux produits ; c’est cependant cette évolution que la science des mécanismes réactionnels a l’ambition de préciser, au niveau même des molécules ; le but est loin d’être complètement atteint, mais des résultats ont déjà été obtenus.
Partant du principe évident que des molécules doivent, pour réagir, se trouver au même instant en un même point du mélange et que la probabilité d’une telle rencontre, déjà très faible pour trois molécules, est pratiquement nulle au-delà, on considère qu’une réaction est obtenue par la succession d’actes élémentaires (ou processus réactionnels) dont chacun ne met en jeu qu’un très petit nombre de particules, ne rompt et n’établit qu’un très petit nombre de liaisons. Ainsi, la réaction de l’ozone sur le dioxyde d’azote
2 NO2 + O3 → N2O5 + O2
peut être la résultante des processus
NO2 + O3 → NO3 + O2
et
NO2 + NO3 → N2O5.
Chaque processus est caractérisé par sa molécularité, nombre de particules intervenant au premier membre : les précédents sont bimoléculaires ; les particules figurant dans un processus peuvent être des molécules, des ions ou encore des groupements neutres d’atomes, ou des radicaux libres — tel est NO3 — instables et à durée de vie très brève ; leur existence est démontrée par divers procédés, en particulier par spectrographie de masse ou d’absorption.
Chaque processus obéit, en fonction de sa molécularité, à une loi de vitesse dictée par la logique : c’est ainsi que pour un processus bimoléculaire — soit NO2 + O3 → NO3 + O2 —, on doit avoir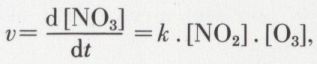
car la vitesse est proportionnelle à la fréquence des rencontres, qui, logiquement, est proportionnelle à la molarité de NO2 et de O3, donc à leur produit.
Une suite de processus ne peut être acceptée comme mécanisme possible d’une réaction que si l’on peut, à partir des lois de vitesse de chacun des processus, retrouver la forme de la loi expérimentale de vitesse de la réaction ; il est souhaitable, d’autre part, que la présence des intermédiaires supposés soit expérimentalement démontrée. Une réaction peut ne comporter qu’un processus ; elle est dite « simple », et sa loi expérimentale de vitesse satisfait à la logique déjà vue. Telles sont : l’estérification d’un alcool et, à l’inverse, l’hydrolyse d’un ester, la synthèse thermique de l’iodure d’hydrogène et, à l’inverse, sa dissociation. Ces réactions sont peu nombreuses.
Réactions en chaînes
Elles constituent un exemple remarquable de mécanisme élucidé à l’aide de la notion de processus : telle est par exemple la synthèse thermique de HBr gazeux suivant
H2 + Br2 → 2 HBr ;
sa loi expérimentale de vitesse, compliquée, s’interprète parfaitement à l’aide des processus suivants :
1. Br2 → Br + Br (processus d’initiation) ;
2. Br + H2 → HBr + H ;
2′. H + Br2 → HBr + Br
et ainsi de suite un grand nombre de fois ; chaque processus de propagation 2 ou 2′ conditionne le suivant et constitue un maillon d’une chaîne qui peut en comporter des milliers ; on doit cependant envisager un processus d’interruption 3. Br + Br → Br2,
ainsi qu’un processus de retour en arrière 4. H + HBr → H2 + Br pour une interprétation correcte de la loi expérimentale. La réaction précédente est dite « en chaînes linéaires », car un processus de la chaîne en entraîne seulement un autre ; mais les chaînes sont ramifiées dans la synthèse de l’eau, où certains maillons en entraînent deux ; cette ramification peut favoriser la tendance à l’explosion, comme la favorise aussi la création, en un temps très court, de nombreux centres initiateurs.
Il en est ainsi pour le mélange H2 + Cl2 frappé par la lumière solaire directe, les molécules de chlore pouvant se dissocier après absorption d’un photon de courte longueur d’onde.
À l’inverse, la vitesse d’une réaction en chaînes est fortement diminuée dans des conditions où les processus d’initiation sont rares, puisqu’une chaîne exige un centre initiateur pour démarrer. Certaines substances, mélangées même à faible dose aux réactifs, peuvent empêcher le démarrage d’une réaction en chaînes, ou tout au moins retarder son évolution, en s’unissant aux centres initiateurs dès la formation de ceux-ci ou encore par interruption de chaîne ; ce sont des inhibiteurs, dont voici quelques exemples : l’oxygène exerce une action inhibitrice dans la substitution du chlore sur un carbure d’hydrogène saturé ; le plomb tétraéthyle Pb(C2H5)4 est utilisé pour retarder l’apparition du régime de détonation (cognement) dans les moteurs à explosion ; son action d’inhibition est celle des radicaux libres C2H5 formés par dissociation thermique du plomb tétraéthyle ; les aminés aromatiques, phénols ou diphénols, comme l’hydroquinone, inhibent les réactions d’oxydation lente par l’oxygène moléculaire, que subissent des substances organiques comme l’aldéhyde benzoïque ou minérales comme SO2 en solution ; ces substances inhibent aussi des réactions de polymérisation dont l’oxygène est la cause indirecte, comme celle de l’acroléine CH2 = CH — CHO ; on les a dénommées anti-oxygènes (Charles Moureu et Charles Dufraisse) ; leur action a été parfois confondue avec une action catalytique de caractère négatif.
Interprétation du rôle de la température
Dans un gaz, les chocs de deux molécules sont si fréquents que, si toutes les rencontres étaient suivies de réactions, il n’y aurait que des réactions pratiquement instantanées ; on est donc conduit à admettre que seules sont efficaces les rencontres qui mettent en jeu un minimum d’énergie ; or, il résulte d’une formule due à Boltzmann* que, dans un gaz en équilibre isotherme comportant N molécules, le nombre n de celles qui présentent avec l’énergie moyenne un écart égal ou supérieur à ΔE est 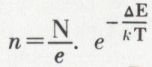 (k [constante de Boltzmann]
(k [constante de Boltzmann] 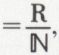 ℕ étant le nombre d’Avogadro) ; la comparaison avec la formule d’Arrhenius montre que l’énergie d’activation est, par rapport à l’énergie moyenne, le supplément que les molécules doivent emprunter pour réagir ; c’est une barrière énergétique que franchissent les molécules, comme on franchit un col pour passer d’une vallée dans une autre. On considère que cet état de plus haute énergie s’accompagne de la formation, à partir des réactifs, d’un complexe dit « activé », dans lequel des liaisons nouvelles sont déjà en formation, alors que les anciennes ne sont pas encore tout à fait détruites, et qui, en raison de son instabilité, peut faire retour au mélange qui l’a formé ou, au contraire, évoluer vers un mélange de produits.
ℕ étant le nombre d’Avogadro) ; la comparaison avec la formule d’Arrhenius montre que l’énergie d’activation est, par rapport à l’énergie moyenne, le supplément que les molécules doivent emprunter pour réagir ; c’est une barrière énergétique que franchissent les molécules, comme on franchit un col pour passer d’une vallée dans une autre. On considère que cet état de plus haute énergie s’accompagne de la formation, à partir des réactifs, d’un complexe dit « activé », dans lequel des liaisons nouvelles sont déjà en formation, alors que les anciennes ne sont pas encore tout à fait détruites, et qui, en raison de son instabilité, peut faire retour au mélange qui l’a formé ou, au contraire, évoluer vers un mélange de produits.




