stéréochimie organique (suite)
Stéréochimie dynamique
Empêchement stérique
Chaque atome peut être considéré comme environné d’un volume impénétrable à un autre atome (sphère de Van der Waals). En conséquence, on ne peut envisager l’existence d’une molécule dont aucune conformation n’échappe à l’interférence entre deux radicaux. Pour la même raison, des substituants volumineux peuvent entraver la libre rotation, comme nous l’avons vu dans l’étude de l’atropo-isomérie. C’est la tendance de divers radicaux à s’écarter le plus possible les uns des autres qui rend les conformations « étoilées » plus stables que les positions « éclipsées » et les conformations « chaise » plus stables que les conformations « bateau ».
Mais les radicaux encombrants peuvent ralentir et même paralyser certaines réactions. Par exemple, si l’amide I s’hydrate facilement en sel d’ammonium, l’amide II réside énergiquement à l’hydratation :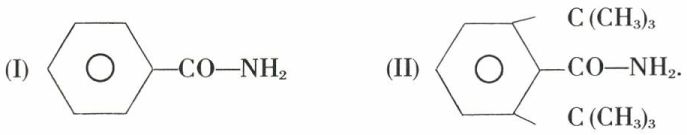
Accélération stérique
C’est la manifestation inverse de la précédente : trois substituants encombrants d’un même carbone tendent à s’écarter, et le bromure I est des milliers de fois plus actif que le bromure II dans certaines réactions de mécanisme dit « SN1 » :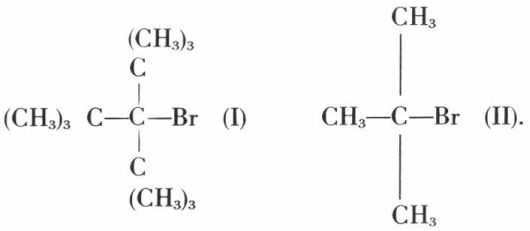
En effet, ces réactions se font par l’intermédiaire d’un carbocation dans lequel le carbone central et les trois carbones qui lui sont liés sont coplanaires ; or, la compression qui s’exerce entre les trois radicaux très encombrants —C(CH3)3 impose au bromure I des angles valentiels  très proches de ceux (120°) qu’ils auront dans le carbocation ; le passage du bromure au carbocation correspond à une modification minime de ces angles valentiels, ce qui n’est pas le cas pour le bromure II.
très proches de ceux (120°) qu’ils auront dans le carbocation ; le passage du bromure au carbocation correspond à une modification minime de ces angles valentiels, ce qui n’est pas le cas pour le bromure II.
Inversion de Walden
Si, sur un antipode optique représenté par
on effectue une réaction d’échange remplaçant T par T′, on ne peut, dans l’ignorance du processus réactionnel, savoir si le nouveau composé doit être écrit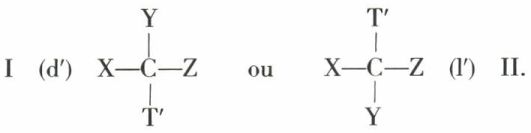
Expérimentalement, tous les cas peuvent se présenter ; si le nouveau composé a la structure I, on écrit simplement
d → d′.
On dit qu’il y a rétention de structure stérique.
Si le nouveau composé a la structure II, on écrit
On a alors affaire à une « inversion de Walden » totale. Mais il arrive aussi que le composé obtenu soit précisément le racémique I + II ; on écrit
d → 1/2 d′ + 1/2 l′,
et la réaction est dite « s’effectuer avec racémisation totale ».
Tous les cas intermédiaires ont été rencontrés, la réaction conduisant alors à un mélange de d′ et de l′ en quantités inégales (racémisation partielle).
Les exemples de rétention sont les plus rares, tout au moins si la liaison rompue intéresse directement le carbone ; par contre, on l’observe constamment dans le cas contraire :
Dans les réactions en un seul stade, dites « SN2 », l’inversion de Walden est la règle :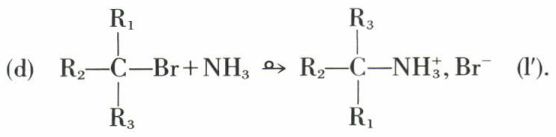
Dans les réactions en deux stades, dites « SN1 », on prévoit la racémisation totale :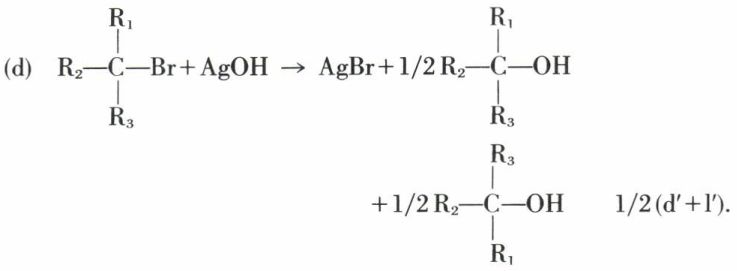
Mais ces règles générales ne sont pas toujours suivies quantitativement.
Principe de trans-addition
L’addition de deux radicaux sur une liaison éthylénique bisecondaire conduit à des résultats différents, selon que l’on met en œuvre l’oléfine cis ou l’oléfine trans ; dans le cas de l’addition du brome, on a les résultats suivants :
On dit alors qu’il s’agit d’une « trans-addition ». Il est à remarquer que ce résultat s’interprète très mal dans la représentation de Van’t Hoff, qui écrit la double liaison sous forme de deux tétraèdres accolés. On pourrait pressentir
En fait, la trans-addition est le phénomène le plus général, mais il existe aussi des cis-additions :
On les explique par le passage par un intermédiaire.
Épimérisation
En milieu alcalin, un acide α-alcool secondaire s’isomérise :
Si R n’est pas asymétrique, on aboutit finalement à une racémisation. Si R est asymétrique, seul le carbone voisin de  est inversé :
est inversé :
Ces deux ions sont, l’équilibre atteint, en quantités inégales ; l’un est un « épimère » de l’autre, et l’isomérisation partielle est appelée épimérisation ; elle a joué un rôle important dans l’étude des sucres (v. glucides).
Dédoublement des racémiques
Deux inverses optiques ayant mêmes propriétés physiques ne peuvent, en principe, être séparés par analyse immédiate ; cependant, la cristallisation fractionnée n’est pas un phénomène d’équilibre parfait, et il arrive, dans quelques très rares cas heureux, qu’une solution d’un racémique laisse déposer, côte à côte, des cristaux des deux énantiomorphes ; si, de plus, ces cristaux sont assez volumineux et se distinguent les uns des autres par leur aspect extérieur (hémiédrie), ils peuvent être séparés à la pince et répartis en deux lots.
Mais il existe une méthode plus générale. Le racémique D + L est combiné à une substance active Λ ; il en résulte un mélange de DΛ et de LΛ, qui ne sont pas inverses optiques, mais diastéréo-isomères, en principe séparables par cristallisation fractionnée ; on remonte ensuite de DΛ à D et de LΛ à L.
Enfin, des micro-organismes détruisent, parfois sélectivement, l’un des constituants d’un racémique, ce qui permet de retrouver l’autre inaltéré.
Ces trois méthodes, dues à Pasteur, ne sont que très faiblement concurrencées par d’autres, plus récentes, mais moins efficaces.
Synthèse asymétrique
Pasteur, le premier, a énoncé ce principe général : il n’est pas possible de préparer un composé actif à partir de substances inactives ; on aboutit soit à un inactif, soit à un racémique, ou encore à un mélange de ces composés.
Ce principe, en opposition avec l’asymétrie de la matière vivante, qui puise ses matières dans l’eau, l’azote, le gaz carbonique, a suggéré des expériences nombreuses : essais de « synthèse asymétrique de première espèce », c’est-à-dire de la construction d’un carbone asymétrique dans un espace dissymétrique (champ électrique + champ magnétique). Tous ces essais ont échoué.




