stéréochimie organique (suite)
Si les carbones asymétriques ne font pas partie d’une même chaîne linéaire, les conclusions sont un peu différentes ; c’est ainsi qu’à la formule  correspondent seulement cinq isomères, deux couples de racémiques et un inactif ; à cet inactif, on ne peut imposer ni un centre, ni un plan de symétrie, mais il peut être rendu superposable à son image, condition suffisante, mais non encore nécessaire à l’inactivité du lot.
correspondent seulement cinq isomères, deux couples de racémiques et un inactif ; à cet inactif, on ne peut imposer ni un centre, ni un plan de symétrie, mais il peut être rendu superposable à son image, condition suffisante, mais non encore nécessaire à l’inactivité du lot.
• Isomérie cyclanique. L’angle de deux valences du carbone dans CX4 est égal à 109° 28′... Il en diffère peu dans tous les composés acycliques. Cependant, dans un cycle triangulaire, cet angle valentiel est réduit à 60°, ce qui entraîne une tension et une instabilité ; pour la même raison, un cycle quadrangulaire plan supporte une légère tension ; celle-ci devient négligeable pour le cycle pentagonal plan qui impose un angle valentiel de 108°, peu différent de 109° 28′. Si les cycles plus longs étaient plans et convexes, ils seraient soumis à des tensions de sens contraire de celles des petits cycles : 120°, au lieu de 109° 28′ pour le cycle hexagonal ; 180°, au lieu de 109° 28′ pour les très grands cycles ; or, tous ces grands cycles ont même stabilité que les chaînes acycliques ; on en conclut qu’ils ne sont plus plans. Le cycle hexagonal, le mieux étudié, est dépourvu de tension dans une conformation indéformable, dite « forme chaise »,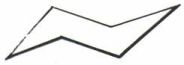
et sous une forme déformable, dite « forme bateau »,
qui peut subir des gauchissements modérés sans tension (formes croisées).
Le cycle chaise est le plus stable, mais l’interconversion des formes chaise-bateau est possible, de sorte que, pour le décompte des isomères, on peut considérer que le cycle est plan.
Les valences qui émanent du cycle chaise peuvent être groupées en deux catégories ; les valences sensiblement perpendiculaires au plan moyen du cycle sont dites « axiales » (a) ; celles qui sont sensiblement dans le plan moyen du cycle sont dites « équatoriales » (e).
La conformation la plus stable des cycles cyclohexaniques substitués est la forme chaise, dans laquelle les substituants les plus encombrants occupent les positions équatoriales.
• Isomérie cyclanique. Raisonnons sur des cycles plans : les cyclanes fondamentaux, leurs dérivés substitués par X, ou gemdisubstitués par X et Y, sont doués d’un plan de symétrie, donc uniques et inactifs :
Par contre, si l’on introduit deux substituants sur deux carbones non diamétralement opposés, on prévoit plusieurs diastéréo-isomères : quatre, tous actifs pour deux substituants différents, un inactif et un couple de racémiques pour deux substituants identiques :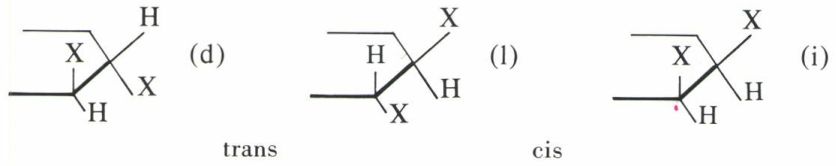
Dans le cas particulier des inositols :
on prévoit et l’on connaît neuf diastéréo-isomères, dont sept inactifs, et un couple de racémiques, ce qui donne en représentation conventionnelle simplifiée :
Mais une isomérie nouvelle apparaît si deux carbones diamétralement opposés sont mono- ou bisubstitués :
Ces composés possèdent un plan de symétrie ; ils sont donc inactifs, mais non identiques. On donne à cette isomérie le nom d’isomérie cis-trans cyclanique.
• Isomérie cis-trans éthylénique (ou géométrique). Les valences émanent de deux carbones doublement liés, et ces deux carbones sont coplanaires ; on en conclut l’existence de deux isomères si chacun des carbones n’est pas symétriquement substitué :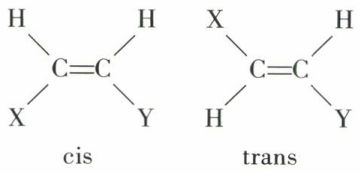
Les isomères cis-trans sont inactifs, car ils peuvent être amenés à présenter un plan de symétrie.
Contrairement aux inverses optiques, les diastéréo-isomères et les isomères cis-trans ont des propriétés physiques différentes et peuvent, en principe, être séparés par analyse immédiate.
• Carbone cryptoasymétrique. Si un spiranne (hydrocarbure comprenant deux cycles avec un carbone commun) est constitué de deux cycles pairs et si chacun d’eux est substitué en position diamétralement opposée au carbone commun, les vecteurs  et
et  sont perpendiculaires dans l’espace :
sont perpendiculaires dans l’espace :
Ces vecteurs peuvent être dextrorsum ou sinistrorsum, et les deux édifices sont asymétriques et inverses optiques ; on prévoit — et on connaît — deux énantiomorphes ; il en est de même pour les composés alléniques et pour les composés mixtes :
Le carbone commun à deux cycles et à deux doubles liaisons ou à un cycle et à une double liaison est appelé carbone cryptoasymétrique.
• Atropo-isomérie. Le noyau benzénique est plan, et les six valences qui en émanent passent par son centre ; si, dans le diphényle
les hydrogènes explicités n’entravent que faiblement la libre rotation autour de la liaison qui unit les noyaux, il n’en est plus de même si ces hydrogènes sont remplacés par des radicaux encombrants ; soient XYZ trois tels radicaux ; les deux noyaux ne peuvent rester coplanaires : la molécule
s’écarte peu de la conformation dans laquelle ces deux noyaux sont perpendiculaires, et, selon que Z est emprisonné entre X et Y au-dessus ou au-dessous du plan de l’hexagone de gauche, on aboutit à deux configurations inverses optiques et non spontanément interconvertibles ; le composé peut être dédoublé en deux antipodes optiques.
Une autre conséquence curieuse de l’entrave à la libre rotation est celle-ci : A étant très encombrant, le composé
semblerait devoir exister sous quatre formes deux à deux inverses optiques, car chaque carbone asymétrique peut prendre deux configurations, et aucune des conformations de ces composés n’est superposable à son image ; mais, si les deux carbones asymétriques ont des configurations inverses, une conformation se transforme spontanément en son image grâce à des rotations permises autour des liaisons CXYZ-noyau ; c’est la condition suffisante à l’inactivité optique d’un lot de cet isomère ; il y a donc seulement un racémique et un inactif.
• Stéréochimie des hétéroatomes. L’oxygène bivalent, bisubstitué par deux radicaux différents, conserve un plan de symétrie ; il ne peut être site d’asymétrie de la molécule.
A priori, on pourrait penser qu’il n’en est pas de même pour l’azote tricoordonné, dont les trois valences ne sont pas dans un même plan, et espérer dédoubler en inverses optiques les amines dissymétriques RN (R)1R2.
Ces dédoublements échouent, car le trièdre formé par les trois valences de l’azote s’inverse instantanément :
(c’est le principe de l’« horloge à ammoniac »).
Il suffit, cependant, d’engager le doublet libre de l’azote dans une valence semi-polaire pour rendre le dédoublement facile ; c’est ainsi que les aminoxydes et les ions ammonium asymétriques
sont connus sous leurs formes optiquement actives.
Pour les mêmes raisons, les ions oxonium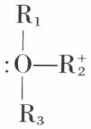
n’ont pu être dédoublés, le trièdre de l’oxygène s’inversant comme celui de l’azote ; il n’en est plus de même pour les composés du soufre tricoordonné, qui sont dédoublables :
Le trièdre du soufre ne s’inverse pas spontanément, non plus que celui du sélénium ou du tellure.
L’azote donne lieu à une isomérie géométrique voisine de celle du carbone ; les oximes d’aldéhydes ou de cétones dissymétriques existent sous deux formes inactives, dites « syn » et « anti » :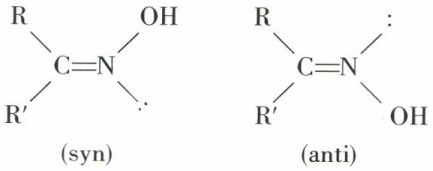
L’azote doublement lié ne s’inverse pas spontanément comme l’azote trivalent.




