solution (suite)
Le point E (t = – 11 °C, τ = 0,2) est le point d’eutexie des solutions eau-KCl ; une solution de titre 0,2, refroidie, ne présente aucun dépôt jusqu’à – 11 °C, où elle se solidifie entièrement, à la manière d’un corps pur, car l’analyse thermique révèle un palier dans le refroidissement des solutions KCl, pour t = – 11 °C ; le dépôt obtenu à cette température n’est cependant pas un corps pur, mais un fin mélange de cristaux de glace et de KCl bien reconnaissables au microscope ; c’est le mélange eutectique, qui fond bien, mais qui ne peut être pris pour un corps pur, car ses deux coordonnées, température et titre, dépendent de la pression, comme l’indique d’ailleurs la règle des phases (2 constituants, 3 phases, v = 1) ; d’où, pour cet équilibre univariant, t = f (p) et τ = g (p).
La courbe à deux branches ON1EM1V est le lieu des points figuratifs de la phase liquide en équilibre avec des cristaux : c’est le liquidus. Quant au solidus, lieu des points figuratifs des phases solides en équilibre avec le liquide, il est ici constitué de deux segments de droites parallèles à l’axe des températures et correspondant à τ = 0 et τ = 1.
Le diagramme précédent fait ressortir une certaine analogie de comportement entre l’eau et le chlorure de potassium. Cette analogie est plus marquée encore dans le refroidissement de mélanges organiques ou de sels fondus, ou d’alliages métalliques, dont les figures 2, 3 et 4 donnent des exemples, sur lesquels on voit qu’une distinction entre solvant et soluté ne peut être que conventionnelle.
Des diagrammes plus compliqués correspondent aux cas où les deux constituants peuvent s’unir pour donner naissance à un ou plusieurs composés définis ; tel est, par exemple, le diagramme Si-Mg (fig. 5) ; c’est aussi le cas de nombreux sels (FeCl3 par exemple), ou d’acides (HNO3 ou H2SO4 par exemple), qui donnent avec l’eau des hydrates stables à leur point de fusion (point de fusion congruent). Au point I du diagramme, que l’on appelle point indifférent, la température d’équilibre solution-solide passe par un maximum, en lequel, par suite d’une légère dissociation au sein du liquide, la pente de la tangente ne subit pas de discontinuité.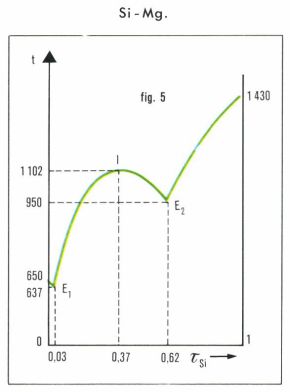
Dans d’autres cas, non moins importants, un composé, un hydrate dans le cas des solutions aqueuses, existe, mais se décompose, sous la pression considérée, à une température qui reste inférieure à son point de fusion. Le diagramme traduit ce fait par l’existence d’un point T, que l’on appelle point de transition ou péritectique. C’est le cas, par exemple, du diagramme eau-NaCl (fig. 6), pour lequel la stabilité de l’hydrate NaCl, 2H2O est limitée à 0,2 °C (p = 1 atm), NaCl anhydre étant seul stable au-delà.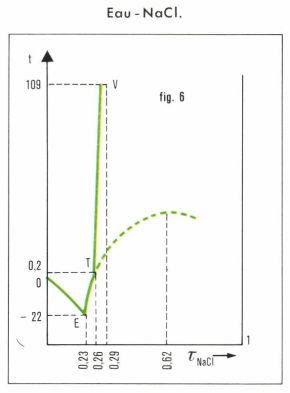
Le refroidissement de certains mélanges binaires offre des diagrammes différents des précédents lorsque les deux constituants sont miscibles à l’état solide, soit totalement, soit dans certaines limites de composition : par refroidissement des liquides, il se dépose des cristaux mixtes, solutions solides homogènes des deux constituants ; la forme du diagramme, celle du liquidus et celle du solidus s’en trouvent modifiées ; les figures 7, 8 et 9 montrent des formes caractéristiques.
Mélanges réfrigérants
Ils sont une application directe des diagrammes à eutectique, eau-NaCl par exemple. Mélangeons, dans un récipient imperméable à la chaleur, de la glace et des cristaux de chlorure de sodium, pris l’un et l’autre à 0 °C. Le diagramme nous enseigne qu’à cette température tous les mélanges stables comportent obligatoirement une phase liquide : de la glace fond, et du sel se dissout dans l’eau de fusion. Ces phénomènes, surtout le premier, sont endothermiques, et le mélange, isolé thermiquement de l’extérieur, se refroidit. On aboutit finalement à un équilibre stable à une température inférieure à 0 °C et comportant la solution en présence : d’un excès de sel si l’on avait mis peu de glace ; d’un excès de glace si l’on avait mis peu de sel ; d’un excès de glace et de sel à la température d’eutexie (– 22 °C), et cela dans certaines limites de composition initiale. On a pratiquement intérêt, en raison, en particulier, des échanges inévitables de chaleur avec l’extérieur, à effectuer le mélange de glace et de sel dans des proportions voisines de l’eutectique (300 g de sel pour 1 kg de glace). Bien d’autres mélanges réfrigérants analogues peuvent être réalisés : le mélange de glace et de CaCl2, 6H2O permet théoriquement d’atteindre une température de l’ordre de – 50 °C.
Solutions diluées, lois de Raoult
Pour les solutions diluées dont le refroidissement fait apparaître des cristaux du solvant pur, on observe un abaissement du point de congélation commençante de la solution, par rapport au point de fusion du solvant. De même, pour les solutions diluées dont le soluté est peu volatil et où, par conséquent, la vapeur qui surmonte la solution est formée du seul solvant, on observe une élévation du point d’ébullition commençante sous une pression donnée par rapport à celui du solvant pur sous cette même pression ; corrélativement, à température donnée, la pression de la vapeur du solvant en équilibre avec la solution est inférieure à la pression de vapeur saturante du solvant.
F. Raoult a énoncé (1883) les lois expérimentales de ces phénomènes. En dehors des réserves précédentes concernant la composition de la phase, solide ou gazeuse, en équilibre avec la solution, les lois de Raoult ne sont applicables qu’aux solutions diluées non électrolytes, dans lesquelles, par conséquent, le corps dissous se trouve exclusivement à l’état de molécules neutres. Pour de telles solutions, l’abaissement du point de congélation, l’élévation du point d’ébullition, l’abaissement relatif de tension de vapeur sont proportionnels au titre pondéral de la solution et inversement proportionnels à la masse molaire du soluté. On écrit :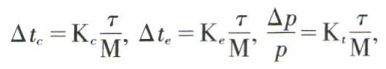
expressions qui traduisent respectivement les lois de la cryométrie, de l’ébulliométrie et de la tonométrie. Kc, Ke, Kt dépendent du solvant. La théorie, en accord avec l’expérience, leur attribue les valeurs suivantes :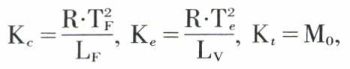
R étant la constante des gaz parfaits relative à la mole, TF et Te les températures Kelvin de fusion et d’ébullition du solvant, LF et LV les chaleurs latentes (enthalpies massiques) de fusion et de vaporisation du solvant, M0 la masse molaire du solvant ; on voit que Kc et surtout Ke dépendent de la pression. Quelques valeurs de Kc et de Ke sont données ci-contre pour quelques solvants (p = 1 atm).




