solution (suite)
Les solutions liquides binaires sont d’une grande diversité : d’abord en raison du grand nombre de solvants et de corps dissous, en ce qui concerne leur nature et leur état physique ; ensuite parce qu’il arrive que la dissolution s’accompagne, souvent à la faveur d’une véritable réaction chimique entre les corps mélangés, d’une ionisation partielle ou totale du corps dissous, qui conduit à une solution ionique, dont les propriétés sont, en raison de la charge électrique des ions, particulières et méritent, de certains points de vue, une étude spéciale (v. acide, base, électrochimie, hydrolyse, oxydoréduction, pH, sel).
La connaissance de la composition d’une solution est une base nécessaire à toute étude. Elle peut être fixée par diverses grandeurs : concentration ou titre. Pour une solution renfermant dans un volume v des masses m0 du solvant et m du soluté, on définit le titre pondéral de ce dernier, 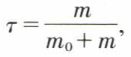 grandeur sans dimensions, et aussi sa concentration,
grandeur sans dimensions, et aussi sa concentration, 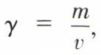 ordinairement en grammes par litre. Cependant, pour une étude théorique, il vaut mieux, n0 et n étant les nombres de moles du solvant et du soluté, fixer la composition par le titre (ou fraction) molaire du soluté,
ordinairement en grammes par litre. Cependant, pour une étude théorique, il vaut mieux, n0 et n étant les nombres de moles du solvant et du soluté, fixer la composition par le titre (ou fraction) molaire du soluté, 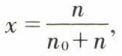 ou par sa concentration molaire, ou molarité,
ou par sa concentration molaire, ou molarité, 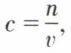 en moles par litre.
en moles par litre.
Solution saturée
Dans un grand nombre de cas, la masse d’un corps que l’on peut dissoudre dans une masse donnée d’un solvant liquide est limitée par le phénomène de la saturation ; la valeur s que prend la concentration pour la solution saturée définit la solubilité du corps dissous dans les conditions (t, p) où l’on opère. Si le corps dissous est un gaz, s dépend de la température et de la pression : la loi de Henry (1803) exprime que le titre molaire du soluté gazeux est, pour la solution saturée à température donnée, proportionnel à la pression du soluté (pression partielle) dans la phase gazeuse qui surmonte la solution. Par contre, si le soluté est solide ou liquide, l’influence de la pression sur la solubilité est faible en général.
William Henry
Physicien et chimiste anglais (Manchester 1775 - Pendlebury 1836). Il a étudié l’action du carbone sur la vapeur d’eau et les propriétés catalytiques du platine divisé. En 1803, il a énoncé la loi de solubilité des gaz.
Chaleur de dissolution
La dissolution est, en général, accompagnée d’un effet thermique, absorption ou dégagement de chaleur suivant les cas. Pour une solution de titre x, on définit une chaleur différentielle de dissolution Λx : si, à la solution de titre x, on ajoute, à p et t constants, dn moles de soluté, on pose dH = Λx dn, où dH est l’accroissement d’enthalpie de la solution correspondant à cette opération ; on définit d’une manière analogue une chaleur différentielle de dilution. Λx dépend en principe de x ; en particulier pour la solution (presque) saturée, on définit Λs, chaleur de dissolution à saturation. D’après les lois du déplacement de l’équilibre, la solubilité est, à p constant, une fonction croissante de la température si Λs est positif, c’est-à-dire s’il y a absorption de chaleur par dissolution au voisinage de la saturation ; c’est le cas de nombreux sels, tels KCl, KNO3, Na2S2O3... Dans le cas contraire, la solubilité décroît quand t augmente, comme c’est le cas pour Na2SO4 si la température est supérieure à 32,4 °C. Enfin, si la dissolution est presque athermique (NaCl), la température a peu d’effet sur la solubilité ; la dissolution est seulement plus rapide.
Sursaturation
Une solution saturée d’un sel, pour laquelle Λs est positif, laisse déposer du sel par refroidissement, tout en restant saturée. Il est cependant fréquent, si le refroidissement est effectué à l’abri des poussières de l’air ainsi que des vibrations et des chocs, qu’aucun dépôt de sel n’apparaisse : la solution est dite alors sursaturée ; elle est dans un état métastable analogue à l’état de surfusion d’un corps pur (v. fusion). Cet état peut persister indéfiniment, mais l’introduction d’un cristal, si petit soit-il, du corps dissous ou d’un cristal isomorphe fait cesser immédiatement la sursaturation, avec dégagement de chaleur et remontée de la température.
Application de la règle des phases aux équilibres des solutions binaires
La règle des phases, v = c + 2 – φ, indique que l’équilibre d’une solution binaire considérée seule est trivariant (2 constituants, 1 phase), les facteurs étant la température, la pression et le titre ; si la solution est saturée, donc en présence d’un excès de soluté solide, l’équilibre est bivariant, et le titre de la solution saturée est fonction de la pression et de la température ; il en serait de même pour une solution en présence d’un excès de solvant solide ou encore en présence d’une phase vapeur, etc. ; nous rencontrerons plus loin quelques applications.
Refroidissement des solutions, point d’eutexie
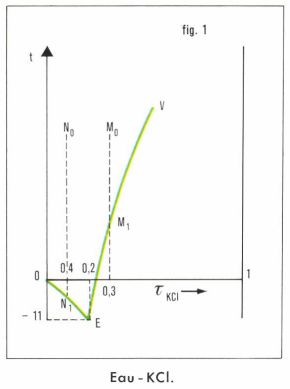
Prenons l’exemple des solutions aqueuses de chlorure de potassium KCl ; la pression est supposée constante et égale à 1 atmosphère. D’une manière générale, et quel que soit le titre initial de la solution, un refroidissement suffisant fait apparaître des cristaux, mais la nature de ceux-ci ainsi que la température d’apparition dépendent du titre initial de la solution. Le diagramme de la figure 1 rassemble les phénomènes observés.
1. On refroidit une solution non saturée de titre τ = 0,3, de point figuratif M0 ; rien ne se dépose jusqu’en M1, où la solution devient saturée en KCl ; par refroidissement (on évite la sursaturation), des cristaux de KCl se séparent de la solution, dont le titre en KCl diminue et dont le point figuratif décrit la courbe de solubilité du sel jusqu’en E, où l’on constate que la solution restante se prend en masse.
2. On refroidit une solution de titre 0,1 en KCl, de point figuratif N0 ; des cristaux de glace apparaissent à une température inférieure à 0 °C ; par refroidissement, de la glace se sépare, et le point figuratif de la solution (saturée en glace) suit la courbe de congélation commençante ; on atteint de nouveau le point E, où la solution restante se prend en masse.