polymorphisme (suite)
Aspect thermodynamique
Lorsque les conditions de température ou de pression sont fixées, l’une des formes polymorphiques est stable, alors que les autres sont instables. La figure 2 donne une image de ces états d’équilibre ; l’état (2), bien que stable, l’est moins que l’état (1) ; il est dit « métastable », et il est nécessaire de lui communiquer une certaine « énergie d’activation », par exemple celle qui est liée à l’agitation thermique, pour le faire basculer dans l’état stable (1). La thermodynamique nous apprend que la phrase stable est celle de moindre « énergie libre » F = E – TS, si les variables d’état sont la température absolue T et le volume ; E est l’énergie interne, et S l’entropie. À la température T = 0 (zéro absolu), F = E, et la forme stable est celle de moindre énergie interne. Quand la température s’élève, le terme TS devient important, et une forme 2, bien que d’énergie interne E2 supérieure à E1, peut apparaître au-dessus de la température de transformation Ti, parce que son énergie libre F2 devient plus petite que F1. À la température de transformation, on a
E1 – TtS1 = E2 – TtS2.
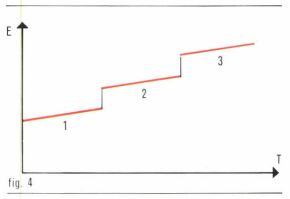
Ainsi, le passage d’une forme stable (1) à basse température dans une forme stable à plus haute température absorbe une quantité d’énergie ΔE = E2 – E1, à laquelle correspond la chaleur latente de transformation ΔE = Tt(S2 – S1) ; [E2 > E1 et S2 > S1] (fig. 3). Si un composé comporte plusieurs formes polymorphiques, les énergies internes sont plus élevées pour les phases stables à plus haute température (fig. 4). La chaleur latente de transformation peut se déduire de la formule de Clapeyron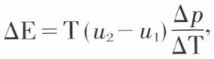
u2 et u1 étant les volumes spécifiques. Cette formule montre que la température de transformation varie avec la pression, mais peu, car u2 – u1 est toujours petit ; si la transformation, en chauffant, se fait avec dilatation (u2 – u1 > 0), la température s’élève si la pression croît  c’est le cas le plus fréquent ; cependant, la transformation par chauffage peut s’accompagner d’une contraction, auquel cas la température de transformation diminue quand on élève la pression.
c’est le cas le plus fréquent ; cependant, la transformation par chauffage peut s’accompagner d’une contraction, auquel cas la température de transformation diminue quand on élève la pression.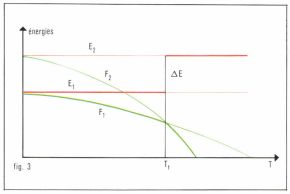
Caractères des phases métastables
On connaît tous les exemples de phases métastables, depuis celles qui ne subsistent qu’un moment jusqu’à celles qui persistent indéfiniment. Ces phases ont toutes en commun de passer dans la phase stable à une température indéterminée, d’avoir une tension de vapeur plus élevée que celle de la modification stable à la même température, d’être plus solubles dans un même solvant, de posséder un point de fusion plus bas. Il en résulte que la cristallisation des formes métastables se produit à partir de solutions fortement sursaturées ou de liquides fortement surfondus.
Détermination des températures de transformation
Les méthodes sont nombreuses et se ramènent à tracer la courbe de la mesure d’une propriété physique en fonction de la température, en maintenant la pression constante ou inversement ; la transformation se marque par une discontinuité endothermique au chauffage et exothermique au refroidissement.
L’analyse thermique est la plus directe. La substance est placée dans un four dont la température varie suivant une loi linéaire du temps. C’est généralement le montage d’analyse thermique différentielle, imaginé par H. Le Chatelier*, qui est utilisé ; on enregistre au moyen de couples thermo-électriques la température de la substance et la différence de température qu’elle présente avec celle d’un corps étalon inerte de capacité calorifique comparable. Cette méthode est très sensible et permet d’opérer avec quelques milligrammes de matière.
La méthode dilatométrique décèle la dilatation ou la contraction à la température de la transformation. Des dilatomètres différentiels sont très sensibles et couramment utilisés par les métallurgistes et les céramistes.
La méthode optique, qui met en évidence soit un changement de couleur, soit une variation de la biréfringence ou du pouvoir rotatoire, a révélé un grand nombre de cas de polymorphisme, grâce surtout au microscope polarisant à platine chauffante, qui utilise une quantité infime de substance. Le changement de couleur est rare ; le premier cas signalé (par Mitscherlich) est celui de l’iodure de mercure, qui est quadratique et rouge au-dessous de 126,3 °C, et orthorhombique et jaune au-dessus de cette température. H. Le Chatelier, ayant découvert la transformation polymorphique α-β du quartz à 573 °C par la méthode dilatométrique, a confirmé ce résultat par la mesure du pouvoir rotatoire et de la biréfringence à des températures croissantes.
La méthode électrique, qui trace la courbe conductibilité électrique-température, est commode pour les corps conducteurs (métaux, alliages), et la méthode thermomagnétique s’applique aux substances ferromagnétiques.
La méthode radiocristallographique, sous la forme de diagrammes de poudre ou de cristal tournant réalisés à des températures ou à des pressions variables, est moins rapide, plus élaborée que les méthodes précédentes, avec l’avantage de fournir des informations plus précises sur les modifications des réseaux cristallins et de l’arrangement des atomes.
Diagrammes d’équilibre
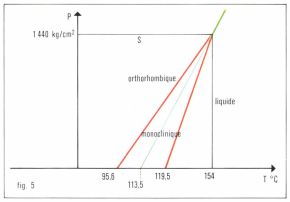
Les domaines de stabilité des différentes phases solides font, depuis 1945, l’objet de nombreux travaux, en particulier pour éclairer, dans un dessein de géophysique, l’état de la matière soumise à des températures et à des pressions élevées. L’initiateur, au siècle dernier, a été Tammann, avec l’exemple classique du diagramme de soufre (fig. 5), qui indique qu’à des pressions élevées, supérieures à 1 440 kg . cm–2, le soufre orthorhombique fond directement à une température supérieure à 154 °C. Puis, entre les deux guerres mondiales, l’Américain P. W. Bridgman mit au point les méthodes des pressions élevées ; citons, parmi son œuvre importante, le diagramme de l’eau avec les domaines de stabilité de six glaces différentes, dont l’une fond à une température aussi élevée que 200 °C quand la pression s’approche de 45 000 kg . cm–2. Ce sont ces recherches qui ont conduit à la synthèse industrielle du diamant. Le diagramme (fig. 6) établi expérimentalement entre 1 500 et 3 000 K explique qu’en chauffant du graphite à 3 000 K, à des pressions de l’ordre de 130 kbar, on le transforme en quelques millisecondes en diamant. Dans l’industrie, on utilise des pressions de 50 à 60 kbar et des températures de 1 400 à 1 600 °C avec un solvant tel que le nickel.