polymorphisme (suite)
Transformations du second ordre
Les transformations décrites jusqu’ici, caractérisées par une discontinuité de l’énergie interne E à la température de transformation, sont dites du premier ordre. Il existe un type de transformation dans lequel l’énergie E1 croît graduellement avec la température, en s’accélérant au voisinage de la température de transformation pour atteindre sans discontinuité l’énergie E2 de la deuxième phase (fig. 7). Dans ce cas, la chaleur spécifique 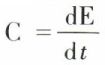 présente une discontinuité à une température dite point λ, et la transformation est dite du second ordre (par exemple fer α en fer β avec la disparition du ferromagnétisme au point de Curie à 774 °C).
présente une discontinuité à une température dite point λ, et la transformation est dite du second ordre (par exemple fer α en fer β avec la disparition du ferromagnétisme au point de Curie à 774 °C).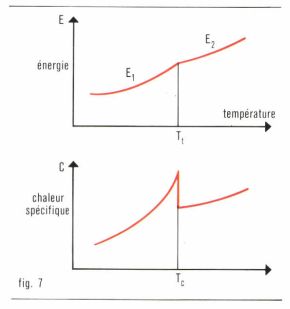
Aspect structural
Au début de ce siècle, les cristallographes (Wyrouboff, G. Friedel [1865-1933]) distinguaient deux types de transformations polymorphiques ; dans les transformations directes ou paramorphiques, généralement rapides et réversibles, les deux formes présentent des relations cristallographiques étroites (par exemple quartz α et β à 573 °C), tandis que les transformations indirectes ou non paramorphiques, difficiles, lentes, sont caractérisées par la transformation profonde des réseaux cristallins. L’établissement des structures atomiques au moyen des rayons X a permis de mieux préciser cet aspect cristallographique. Comme la forme stable à température élevée est celle de plus grande énergie interne, les liaisons atomiques dans le réseau cristallin sont moins solides ; celles-ci, suivant les types de solides, sont de natures différentes, à prédominance soit ionique, soit covalente, ou bien métallique, ou encore de Van der Waals ; aussi les modifications polymorphiques présentent-elles des caractères très variables, et l’on peut les répartir dans quatre classes (Martin Julian Buerger).
Transformations de coordination secondaire
Elles intéressent surtout les composés (non métalliques) de la chimie minérale. La coordination, c’est-à-dire le nombre des plus proches voisins d’un atome ionisé, demeure la même, et les arrangements cristallins ne diffèrent que par la disposition des seconds voisins ; autrement dit, les polyèdres d’anions entourant les cations, en demeurant les mêmes, se lient différemment. La transformation peut se faire suivant deux mécanismes, qui caractérisent la transformation de déplacement et la transformation de reconstruction.
La transformation de déplacement n’entraîne aucune rupture de liaisons atomiques et consiste dans une déformation du réseau. Aussi est-elle aisée, rapide, liée à la vitesse de la transmission de la chaleur dans le solide. La forme à plus haute température possède un réseau plus ouvert, donc de plus faible densité ; sa chaleur spécifique est plus grande ; sa symétrie est plus élevée, ce qui entraîne nécessairement, lors de sa transformation dans la forme à basse température, la formation de macles. La symétrie de la forme à basse température est un sous-groupe de celle qui est stable à température élevée. Un exemple important est la transformation α-β du quartz ; le quartz α, stable jusqu’à 578 °C, a un réseau hexagonal avec une symétrie ternaire, sous-groupe de la symétrie hexagonale du quartz β, qui est stable entre 573 et 870 °C.
La transformation de reconstruction doit franchir une barrière d’énergie plus élevée, puisqu’elle consiste dans une destruction de l’un des réseaux cristallins avec un réarrangement profondément différent des mêmes polyèdres de coordination. Aussi la transformation est-elle lente, visqueuse et, dans un état métastable, une forme peut subsister pendant des périodes géologiques. Par refroidissement, la transformation de reconstruction conduit à une forme à basse température, d’énergie interne plus petite, provenant de liaisons plus solides des atomes seconds voisins, ce qui correspond à un édifice atomique plus compact, donc de plus grande densité. Si aucun agent extérieur n’intervient, la transformation progresse lentement dans tout le cristal ; si la substance a une tension de vapeur non négligeable, la forme stable apparaît, par distillation, à partir de la forme instable ; mais, le plus souvent, la transformation se fait à l’aide d’un solvant approprié, que les minéralogistes appellent minéralisateur, dans lequel la forme instable est plus soluble que la forme stable. Ce sont de tels minéralisateurs (mélanges d’oxydes tels que chaux, alumine, oxydes alcalins) que l’on emploie pour transformer le quartz α en un mélange de tridymite et de cristobalite servant à la fabrication des briques de silice réfractaires pour la construction des fours industriels. Le quartz α, dont la densité est de 2,65, est inutilisable, parce que la transformation instantanée à 573 °C dans la forme β s’accompagne d’une brusque dilatation de 0,86 p. 100. La tridymite (densité 2,26) est stable entre 870 et 1 470 °C, et la cristobalite (densité 2,33) l’est depuis 1 470 °C jusqu’au point de fusion de 1 710 °C.
Polymorphisme marqué par un changement de coordination
Le nombre des atomes au contact d’un atome donné varie. C’est le cas du fer α, cubique centré, dans lequel chaque atome de fer est au contact de huit autres et qui, à 906 °C, devient, sous la forme Fe γ, cubique à faces centrées avec une coordination 12. Le chlorure de césium est cubique avec, à la température ordinaire, une coordination 8 (Cs au centre de la maille, Cl aux sommets) ; à 460 °C, la structure atomique devient celle du chlorure de sodium avec la coordination 6. Ces deux transformations sont rapides ; mais il en existe de très lentes, comme celle de CaCO3 dans la forme calcite (Ca2+ au contact de 6 atomes O2–) et dans la forme aragonite (Ca2+ au contact de 9 O2–).
Modification du type de liaison
Dans le carbone, sous les formes diamant (coordination 4) et graphite (coordination 3) ainsi que dans les étains blanc et gris, un terme est isolant et l’autre métallique. Citons aussi les composés moléculaires organiques, dans lesquels les molécules, dans la forme à basse température, possèdent des liaisons hydrogène, alors que la forme à haute température ne comporte que des liaisons de Van der Waals.




