acides (suite)
Parmi les propriétés des acides, une surtout présente un caractère général et important : l’action sur les bases. Réciproquement, une base est définie par son action sur les acides ; d’où l’idée, déjà ancienne, de considérer une base comme le complément d’un acide (et inversement) et de chercher, pour la réaction acide-base, une interprétation de caractère général et qui traduise cette complémentarité. La théorie des ions, formulée en 1887 par le Suédois Arrhenius*, permit une telle interprétation : un acide est un corps qui libère, par dissociation de sa molécule, en solution aqueuse, des ions H+ ; une base libère de même des ions OH– ; la réaction acide-base consiste essentiellement en la formation d’eau par la réaction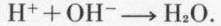
Les acides diffèrent les uns des autres par leur tendance plus ou moins grande à se dissocier ; en général, un équilibre s’établit, dans la solution aqueuse d’un acide, entre la forme moléculaire, non dissociée, et les ions, produits de dissociation :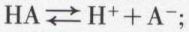
l’acide est d’autant plus fort que, toutes choses égales d’ailleurs, l’équilibre est davantage déplacé vers la droite ; l’application de la loi d’action de masse à cet équilibre fournit la relation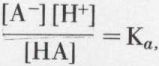
Ka, constante d’acidité, caractérise l’acide à température donnée ; elle varie d’un acide à l’autre proportionnellement à [H+] ; l’acide le plus fort a donc la plus grande constante d’acidité.
La chimie doit beaucoup à la théorie d’Arrhenius ; cependant, l’interprétation des propriétés des acides (et des bases) découlant d’une dissociation partielle de ceux-ci a rencontré des difficultés : on a dû, en particulier, admettre qu’un certain nombre d’acides sont complètement dissociés en solution ; il ne leur correspond donc pas de constante Ka, et leur classement devient impossible : ce sont les acides « forts », tels que HNO3, HCl, HClO4, et d’autres. Le classement ne s’applique qu’aux acides « faibles » : acides organiques en général, acides nitreux, sulfureux, carbonique, etc.
Johannes Brønsted a proposé en 1922 une théorie des acides et des bases qui, plus générale que celle d’Arrhenius, s’affranchit de ces difficultés. On appelle acide tout corps, molécule ou ion, capable de céder un proton ; on appelle base tout corps, molécule ou ion, capable de fixer un proton. En règle générale, la tendance d’un acide à céder un proton,
est limitée par celle, inverse, que possède B à fixer un proton ; cela se traduit par le schéma d’équilibre
ce qui fait de B une base, qu’on nomme conjuguée de l’acide A. L’analogie avec la définition des oxydants et des réducteurs, schématisée par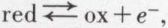
est évidente, et A ⇄ B + p+ définit le couple acide-base. De même qu’une réaction effective d’oxydoréduction est toujours la combinaison de deux couples redox, une réaction effective acide-base est la combinaison de deux couples acide-base : le proton ne pouvant exister de façon permanente à l’état libre dans les solutions, un corps ne peut fonctionner comme acide que si une base (autre que sa base conjuguée) est présente pour capter les protons émis par l’acide. Ainsi CH3—COOH est un acide, dont la base conjuguée est l’ion acétate :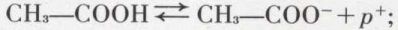
de même l’ion ammonium est un acide, dont la base conjuguée est l’ammoniac : 
par combinaison de ces deux couples, on obtient la réaction acide-base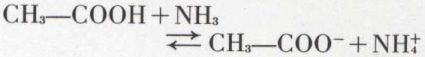
de l’acide acétique sur l’ammoniac. Le rôle du solvant (l’eau par exemple) est très important dans l’interprétation de Brønsted : l’eau est un solvant partiellement ionisé renfermant des protons hydratés qu’on peut formuler H3O+ (ion hydroxonium) et des ions OH– (ion hydroxyde). L’équilibre au sein de l’eau de ces ions peut être considéré comme résultant de la réaction
réaction acide-base, combinaison des couples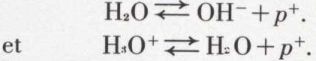
Le premier de ces couples traduit la tendance de l’eau à céder un proton, l’autre la tendance de l’eau à fixer un proton ; l’eau est donc un corps amphotère, un ampholyte. Si on y dissout un acide, par exemple l’acide acétique, l’eau, fonctionnant comme base, réagit avec l’acide :
de même, si on dissout NH3 dans l’eau, celle-ci, fonctionnant comme acide, donne la réaction
Ces réactions chimiques sont à l’origine des ions H+ (hydratés) et OH– des solutions aqueuses. Ces considérations sont généralisables à d’autres solvants, tels l’acide acétique ou l’ammoniac liquide anhydres.
La force d’un acide est ici définie par la tendance à céder un proton et mesurée par la constante de l’équilibre de dissolution de l’acide ; elle a la même valeur, pour la solution aqueuse, que dans la théorie d’Arrhenius. Un certain nombre d’acides, cependant, donnent avec l’eau une réaction complète ; ce sont les acides forts d’Arrhenius ; avec HCl, par exemple, HCl + H2O → Cl– + H3O+, et la solution ne renferme que l’acide H3O+ ; l’eau produit donc pour ces acides un effet de nivellement des propriétés. Ces acides ne possèdent évidemment pas de constante Ka définie par la solution aqueuse, mais un autre solvant convenablement choisi (l’acide acétique par exemple) ne donnera pas avec ces acides de réaction complète et permettra pour chacun d’eux la mesure d’une constante d’acidité Ka. Un classement d’après la force est donc possible pour tous les acides (de même pour les bases).
Une interprétation plus générale encore est due à Lewis (1923) : la réaction acide-base est l’échange d’un doublet électronique entre deux corps, dont l’un, l’acide, est accepteur du doublet et l’autre, la base, est donneur. Ainsi H+ est acide de Lewis, car il accepte un doublet de OH– pour donner H2O ; mais BCl3 est aussi acide de Lewis, car il accepte un doublet de NH3 pour donner le composé covalent BCl3NH3. L’interprétation de Lewis joue un rôle important, en particulier dans l’explication de certains mécanismes réactionnels.
R. D.
R. P. Bell, Acids and Bases (New York, 1952). / Les Acides (Dunod, 1959). / L. Rougeot, Acides et bases (P. U. F., coll. « Que sais-je ? », 1970).




