acides-alcools
Composés dont la molécule renferme au moins une fois la fonction acide carboxylique et la fonction alcool. Le plus simple est l’acide glycolique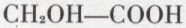
ou éthanoloïque.
Ce groupe comprend de nombreux produits naturels, les plus anciennement isolés parmi les composés organiques définis : acide lactique (du lait), acide malique (des pommes), acide tartrique (des vins), acide citrique (du citron), etc. Solubles dans l’eau, de saveur aigrelette agréable, non toxiques, plusieurs de ces produits naturels participent à la confection des limonades. Leur intérêt théorique n’est pas moindre ; leur étude sera toutefois limitée ici à celle des monoacides-monoalcools.
Préparations
Elles diffèrent essentiellement avec la distance des deux fonctions dans la molécule, ce qui amène à une étude séparée.
Les acides α-alcools, par exemple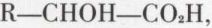
se préparent généralement à partir des acides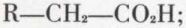
la chloration conduit sélectivement à l’acide α-chloré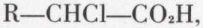
hydrolysable en acide α-alcool ; on peut également réduire les acides α-cétoniques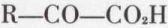
et diazoter les acides aminés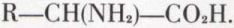
Une méthode synthétique est l’addition de l’acide cyanhydrique à un dérivé carbonylé :
nitrile-alcool, hydrolysable en sel d’ammonium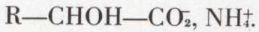
Les acides β-alcools, par exemple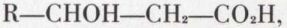
résultent de l’addition réversible de l’eau sur les acides α-éthyléniques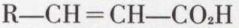
et de la réaction de Reformatzki :
hydrolysable en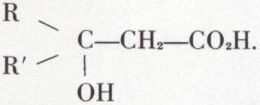
Les acides γ- et δ-alcools, par exemple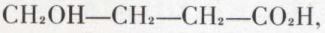
ne sont que rarement isolables sous cette forme ; leur étude revient à celle des lactones (v. plus loin) ; la synthèse de ces dernières résulte de l’hydrogénation ménagée (eau + sodium amalgamé) des anhydrides cycliques de diacides -γ (ou -δ) :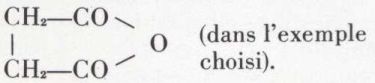
Propriétés physiques
Les premiers termes de la série sont généralement cristallisés et très solubles dans l’eau ; leur acidité est légèrement supérieure à celle de l’acide à fonction simple de même squelette.
Propriétés chimiques
Les sels des acides γ- ou δ-alcools sont normaux, ainsi que les sels alcalins des acides α- et β-alcools. Mais, dans ces deux derniers cas, les sels de métaux de transition plurivalents sont des complexes internes, tel le sel de cuivre :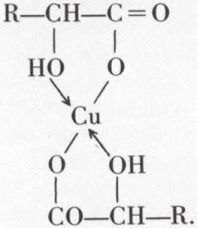
Ces sels ont un point de fusion net, sont solubles dans les solvants organiques et ne précipitent pas Cu(OH)2 en milieu alcalin.
L’estérification réciproque conduit, entre autres choses, à un lactide :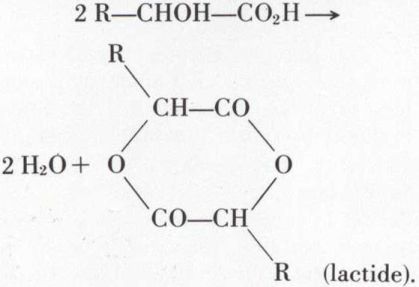
Les acides β-alcools se déshydratent en milieu acide en acide éthylénique (réaction inverse de leur préparation courante).
Les acides γ- ou δ-alcools s’estérifient par une réaction interne inévitable en γ- ou δ-lactone :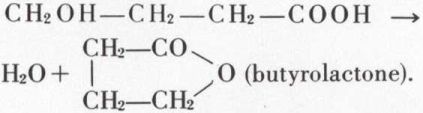
Les lactones sont facilement coupées par les hydracides (en acides γ- ou δ-halogénés), par les bases (en sel d’acide γ- ou δ-alcool) et par le cyanure de potassium :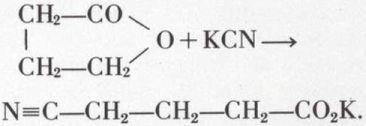
Elles sont réduites par l’amalgame de sodium d’abord en aldéhyde (ou cétone) γ- (ou δ-)alcool, puis en glycols-γ (ou -δ).
Quelques formules d’acides-alcools naturels :
— acide lactique (du lait aigri) :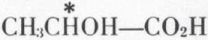
(deux inverses optiques) ;
— acide malique (des pommes) :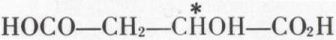
(variété dextrogyre) ;
— acide tartrique (des vins) :
(trois variétés : D, L, méso) ;
— acide citrique (du citron) :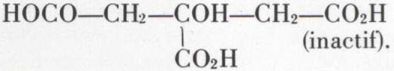
C. P.
acides aminés
Composés qui renferment, dans la même molécule, au moins une fonction acide carboxylique et au moins une fonction amine.
Le plus simple d’entre eux est le glycocolle, ou glycine,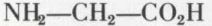
(aminoéthanoïque).
Les plus importants sont les acides α-amine primaire de structure générale
Ce sont les constituants essentiels des protides*, superpolyamides de structure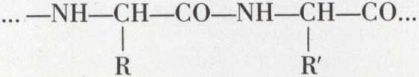
qui, par hydrolyse, conduisent à des mélanges de ces acides aminés. Les divers acides ainsi libérés sont, au maximum, au nombre de 21, mais chacun d’eux peut intervenir un grand nombre de fois dans la structure d’une protéine. De plus, aucun de ces acides ne figure sous les deux formes inverses optiques dans un hydrolysat de protéine. La séparation se fait, de nos jours, par chromatographie sur colonne, sur papier ou sur plaque.
La synthèse des acides aminés racémiques fait appel, comme celle des acides α-alcools, aux acides α-chlorés :
Sans relation avec les substances naturelles, les acides β-aminés se font par addition d’ammoniac aux acides α-éthyléniques :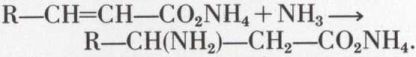
Quant aux acides γ- et δ-aminés, ils sont rarement isolables, s’anhydrisant en lactames (comparables aux lactones) ; les lactames résultent aussi de l’action de l’ammoniac sur les lactones :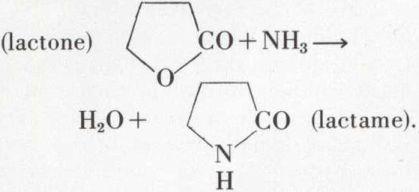
Les acides aminés ont des propriétés physiques très particulières ; ce sont des solides infusibles sans décomposition et ne connaissant guère de solvant en dehors de l’eau, du glycol et du glycérol.
Cela les fait considérer comme des sels internes (amphions ou zwitterions) :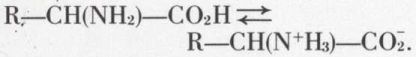
La solution aqueuse pure ne renferme guère que l’amphion. Le milieu alcalin le transforme en un anion :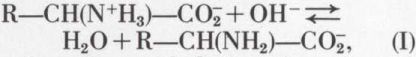
et le milieu acide le transforme en un cation :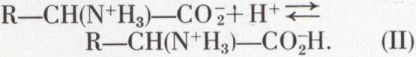
Sous l’influence d’un champ électrique suffisant en milieu alcalin, l’anion se déplace vers l’anode, alors qu’en milieu acide le cation se déplace vers la cathode ; le phénomène porte le nom d’électrophorèse. À un certain pH appelé point isoélectrique, il n’existe guère que des amphions, que le champ électrique ne déplace pas. Ce pH correspond au minimum de conductivité de la solution, et, si R est très lourd, au minimum de solubilité de l’acide aminé.
Il vaut mieux écrire les réactions équilibrées (I) et (II) sous une autre forme :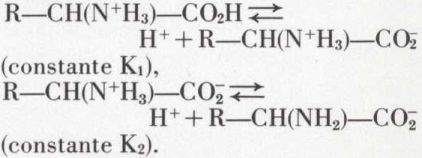
Si l’on désigne par pK1 et pK2 les cologarithmes de ces constantes, le pH du point isoélectrique (pi) est égal à 1/2 (pK1 + pK2).
Les pi étant différents pour les divers acides aminés, l’électrophorèse en solution tamponnée à un pH intermédiaire entre leurs pi permet la séparation de deux acides aminés.
Les propriétés de chacune des deux fonctions deviennent normales dès que l’autre pôle de l’amphion est bloqué ; on peut bloquer l’ion carboxylate par salification ou par estérification et la fonction amine par acétylation ou salification chlorhydrique.
Les sels cuivriques des acides α- et β-aminés, comme ceux des acides α-ou β-alcools, sont des complexes cristallisés qui ne précipitent pas l’hydroxyde Cu(OH)2 en milieu alcalin. H2S en libère l’acide aminé.
Le chauffage d’un acide α-aminé dans le glycérol provoque une déshydratation :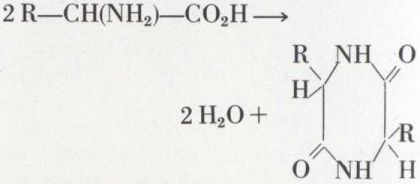
(dicétopipérazine).
Comparables aux lactides, les dicétopipérazines permettent, par un point de fusion net, l’identification de l’acide aminé.
Les acides β-aminés s’isomérisent facilement en sels d’acides α-éthyléniques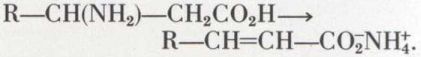
Les acides γ- et δ-aminés se cyclisent en lactames :
C. P.
➙ Protides.




