la transgenèse végétale
GÉNÉTIQUE
Introduction
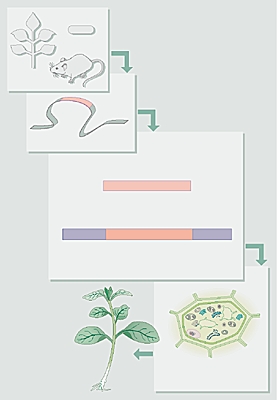
La transgenèse ou la transformation génétique est la modification héréditaire d'un génome à la suite de l'intégration et de l'expression d'un gène étranger. À la différence de l'hybride obtenu par reproduction sexuée, la transformation permet d'introduire dans un organisme, en une seule opération, le nombre de gènes voulu. Les techniques de transformation, développées à l'origine chez les bactéries et les cellules animales, ont pu être adaptées aux cellules végétales grâce aux progrès de la biologie moléculaire et cellulaire végétale. Les cellules végétales, contrairement aux cellules animales ont la particularité d'être totipotentes. Il est possible d'obtenir la dédifférenciation des cellules d'un organe (feuille, tige, ou racine) et d'orienter leur multiplication vers la régénération en plante entière. Pour certaines espèces, il est ainsi possible d'obtenir, à partir d'une cellule transformée, une plante dont toutes les cellules, dérivant de celle manipulée à l'origine, possèdent cette information génétique.
Les méthodes de la transformation génétique
Introduction
Les premières plantes transgéniques ont été obtenues dans les années 1980 (La Recherche, mai 1987). Les plantes cultivées les plus étudiées sont le tabac, la pomme de terre, le colza, les céréales (maïs, blé et riz), et les espèces potagères, en particulier la tomate, le melon et le concombre. Les gènes introduits ou en voie de l'être, sont ceux qui peuvent présenter un intérêt économique pour les grandes entreprises (résistance à des herbicides ou à des agents pathogènes) qui selon leur secteur d'activité principal (semences, agrochimie ou agroalimentaire) se fixent des priorités stratégiques et des choix de recherche. Pour le chercheur, la possibilité d'introduire une information génétique nouvelle dans une espèce végétale constitue avant tout un outil précieux pour l'étude du développement des plantes.
Expression de gènes étrangers dans une cellule végétale
Pour obtenir l'expression d'un gène étranger dans une cellule végétale, il faut généralement le modifier. En effet, un gène est schématiquement constitué de trois régions :
– la séquence codante, qui correspond à la séquence d'A.D.N. transcrite en A.R.N. messager, lequel est ensuite traduit en protéine ;
– le promoteur, situé en amont de la séquence codante, région régulatrice déterminant le plus souvent la spécificité d'expression (par exemple, le gène est actif dans les feuilles) ;
– une région terminale, en aval de la séquence codante.
Comme un gène d'origine bactérienne ou animale n'est pas actif dans une cellule végétale, il faut placer la séquence codante entre des signaux de régulation qui permettent son expression dans un contexte végétal. Le gène ainsi créé est dit « chimérique ».
Deux types de techniques sont actuellement utilisées pour transformer les cellules végétales : l'une est basée sur l'utilisation des propriétés naturelles de bactéries du sol du genre Agrobacterium, l'autre fait intervenir des méthodes physiques ou chimiques qui permettent de forcer la pénétration de l'A.D.N. dans les cellules.
Utilisation d'un processus de transfert naturel
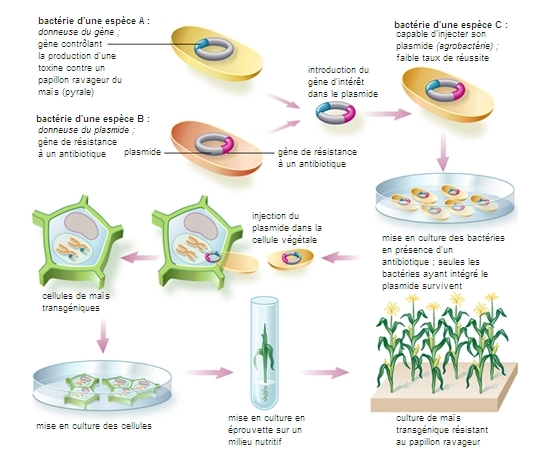
Agrobacterium tumefaciens et A. rhizogenes sont deux bactéries phytopathogènes du sol qui possèdent l'étonnante propriété de pouvoir transférer une partie de leur information génétique dans les cellules végétales de nombreuses dicotylédones, ainsi que de quelques monocotylédones et gymnospermes. Ces microorganismes infectent les plantes au niveau de blessures et provoquent la multiplication des cellules sous forme de tumeurs (galle du collet) dans le cas d'A. tumefaciens, et sous forme de racines néoformées dans le cas d'A. rhizogenes. Depuis le début du siècle, les phytopathologistes se sont intéressés à la galle du collet en raison de l'importance des dégâts causés par A. tumefaciens sur certaines plantes cultivées et de son intérêt comme cancer végétal. La maladie est provoquée par le transfert d'un fragment d'A.D.N., l'A.D.N.-T porté par un plasmide hébergé par la bactérie, qui est capable de s'intégrer au génome de la plante. Les symptômes résultent de l'expression des gènes qui ont été transférés des plasmides bactériens (plasmides Ti) au génome végétal. Les plasmides Ti et Ri d'A. tumefaciens et A. rhizogenes sont couramment utilisés pour la transformation génétique des plantes. Ces vecteurs, qui induisent à l'état naturel la formation des tumeurs, peuvent être artificiellement débarrassés des gènes responsables de la maladie. Leur emploi comme véhicule de gènes étrangers est efficace, sauf dans le cas d'espèces végétales pour lesquelles la régénération de plantes entières à partir d'explants n'est pas maîtrisée. Certaines espèces végétales, en particulier les monocotylédones, se prêtant mal à cette méthode, d'autres stratégies ont été développées.
Les méthodes de transfert direct de gènes
Introduction
Diverses méthodes chimiques ou physiques sont employées pour introduire un gène étranger dans une cellule végétale. On distingue, le traitement au polyéthylèneglycol (P.E.G.), l'électroporation et la biolistique.
Le traitement au polyéthylène glycol (P.E.G.)
Dans cette méthode chimique, des protoplastes, cellules végétales débarrassées de leur paroi pectocellulosique, sont incubées en présence d'A.D.N. et de P.E.G. Cet agent chimique entraîne une déstabilisation de la membrane cytoplasmique des protoplastes et la formation de pores permettant la pénétration de l'A.D.N. Certaines molécules d'A.D.N. parviennent ainsi au noyau de la cellule et s'intègrent dans les chromosomes.
L'électroporation
Dans cette méthode physique, les protoplastes sont soumis à un champ électrique de très courte durée et de tension élevée en présence de l'A.D.N. à transférer. Le choc électrique induit la formation de pores dans la membrane, par lesquels l'A.D.N. pénètre.
La biolistique
Dans cette méthode physique, des billes de tungstène, d'or, ou de platine, enrobées d'A.D.N., sont projetées à grande vitesse et pénétrent à travers la paroi des cellules d'explants ou de massifs embryogènes. L'A.D.N. ainsi transféré est libéré et peut s'intégrer au génome de la cellule hôte.
Les applications de la transgenèse chez les plantes
Introduction
Les années 1980 ont été marquées par la mise au point de méthodes de transformation sur des systèmes biologiques modèles comme le tabac, en particulier avec des gènes de résistance à des antibiotiques. Par la suite, des gènes d'intérêt agronomique ont été identifiés, clonés, puis introduits dans des plantes cultivées, et des essais aux champs de plantes transformées ont été réalisés. Les premiers travaux d'introduction de gènes dans des plantes ont porté sur des caractères simples. Il n'est, en effet, pas encore envisageable d'agir sur des caractères complexes, mettant en jeu plusieurs gènes, comme la productivité ou certains aspects de la qualité. Les applications industrielles sont variées : elles concernent l'obtention de plantes mâles stériles, de plantes résistantes aux herbicides, à des agents pathogènes (virus, champignons, bactéries, nématodes) ou à des insectes ravageurs. D'autres recherches conduisent à modifier les caractéristiques des produits (amélioration des éléments de réserve, des huiles végétales, maturation des fruits, couleur des fleurs). Enfin, récemment, les chercheurs ont transformé génétiquement des plantes pour leur faire produire différents types de molécules d'origine non végétale comme l'albumine, l'interféron, l'alpha-amylase, des polymères naturels, des anticorps monoclonaux.
La résistance aux herbicides
L'étude des résistances aux herbicides observées chez les bactéries, chez certaines adventices et chez des plantes sélectionnées par culture in vitro a permis de mettre en évidence plusieurs mécanismes de tolérance. À partir de ces résultats, différentes stratégies ont été développées pour obtenir des plantes tolérantes aux herbicides : surproduction de l'enzyme cible de l'herbicide, modification de l'enzyme cible, détoxification de l'herbicide. Des plantes transgéniques tolérantes à différents herbicides ont été obtenues par des entreprises spécialisées dans les biotechnologies.
La résistance aux pathogènes
La résistance aux insectes
L'une des méthodes développées pour obtenir des plantes résistantes aux insectes repose sur l'utilisation d'une protéine produite par la bactérie Bacillus thuringiensis et toxique pour telle ou telle catégorie d'insectes. Au cours de la sporulation, cette bactérie produit des inclusions cristallines constituées d'une protéine appelée endotoxine, qui se fixe sur les cellules épithéliales du tube digestif des insectes. Il existe plusieurs souches possédant des toxicités différentes. Cette bactérie, dont les effets toxiques sont limités aux seuls insectes, est utilisée comme biopesticide depuis une vingtaine d'années. La protéine purifiée est aussi employée pour lutter contre les insectes mais son extraction est d'un coût élevé et elle est très instable à la lumière. Plusieurs gènes bactériens codant pour des delta-endotoxines ont été isolés et utilisés pour la construction de gènes chimériques qui ont été introduits dans des plantes. La société belge Plant Genetic Systems a ainsi obtenu en 1986 des plantes résistantes à une chenille de lépidoptère, Manduca sexta, responsable de gros dégâts dans les cultures de tabac aux États-Unis.
La résistance vis à vis des bactéries
L'isolement de gènes de résistance est prometteur, non seulement pour les applications agronomiques directes mais également pour la compréhension des mécanismes qui contrôlent la résistance spécifique chez les plantes et le déclenchement des réactions de défense. Ces gènes vont pouvoir être introduits dans des lignées sensibles et éventuellement dans d'autres espèces. Les nouveaux génotypes qui seront ainsi créés pourront être utilisés pour raccourcir les programmes de sélection. Par exemple, le gène Xa21, isolé en 1995 de Xanthomonas oryzae, a été transféré par génie génétique à une variété cultivée. Ce gène a été introduit dans différentes variétés de riz cultivées par des chercheurs de l'O.R.S.T.O.M., notamment en Afrique pour lutter contre la bactériose du riz, responsable de ravages considérables atteignant 10% des récoltes.
Lutte contre les virus
Il n'existe pas de traitement chimique prophylactique ou curatif contre les virus des végétaux. Outre l'élimination des plantes virosées, deux parades seulement sont envisageables : soit rechercher, parmi les espèces répertoriées, des plantes résistantes, qui seront intégrées dans les schémas de sélection (cependant, il n'existe pas nécessairement des gènes de résistance à certains virus chez les espèces sauvages), soit appliquer sur les cultures des souches de virus avirulents, qui ne provoquent pas de symptômes (celles-ci induisent chez la plante la mise en place de mécanismes de défense lui assurant une protection contre une nouvelle infection par des souches virulentes).
Il est aujourd'hui possible d'envisager d'autres stratégies basées sur l'introduction dans les plantes de gènes constitués de fragments de génome viraux dont les produits, A.R.N. ou protéines, vont ralentir ou arrêter la prolifération d'un virus infectieux. Ces modifications confèrent à la plante une certaine prémunition contre des infections virales. En 1985, une équipe de chercheurs nord-américaine, en collaboration avec la société Monsanto, a démontré pour la première fois que l'expression du gène codant pour la protéine de l'enveloppe du virus de la mosaïque du tabac, dans des plantes de tabac ou de tomate, les protège d'une infection par ce même virus. Cette méthode a été utilisée depuis avec succès pour d'autres espèces végétales et d'autres virus.
L'adaptation du produit
Chez la tomate, il est possible de retarder la maturation des fruits. Par génie génétique, on peut inactiver le gène codant pour une enzyme nécessaire à la maturation, par exemple une polygalacturonase ; une enzyme capable d'hydrolyser les sucres, en particulier, les enchaînements de glucose. Les fruits obtenus par cette manipulation se prêtent mieux à la récolte mécanique, restent fermes durant plusieurs semaines, et se sont révélés moins sensibles aux agents pathogènes. Aux États-Unis la société Calgene a introduit sur le marché une telle variété de tomates, ayant un contenu réduit en polygalacturonase. Ce sont les premières plantes transgéniques commercialisées.
Les applications thérapeutiques
Depuis une vingtaine d'années, l'industrie pharmaceutique utilise des bactéries génétiquement modifiées pour produire certaines molécules qui ne peuvent pas être synthétisées par les techniques classiques de la chimie. Cependant, certaines transformations nécessaires à l'activité des protéines ne peuvent pas être réalisées par les bactéries. Pour surmonter ces limites, les champignons tels que des levures ont d'abord été utilisés. Depuis quelques années des essais sont en cours avec les plantes, par exemple, la production d'une protéine nécessaire au traitement de la mucoviscidose, ou d'hémoglobine.
Conclusion
En l'espace d'une quinzaine d'années, l'amélioration des conditions de régénération et la maîtrise des méthodes de transgenèse ont permis d'élargir le nombre des espèces végétales accessibles à la transformation génétique. Toutefois au sein d'une espèce, la fréquence de transformation peut varier considérablement. Parallèlement, de nombreux progrès ont été réalisés dans l'étude de l'expression des gènes. Cependant, les études menées dans ce domaine montrent que les cellules n'acceptent pas toujours une information génétique supplémentaire et qu'elles peuvent mettre en place des mécanismes de régulation conduisant à l'inactivation du transgène. Dans certains cas il a été observé que l'introduction d'une copie supplémentaire d'un gène préexistant peut aboutir à l'extinction non seulement du transgène mais également du gène endogène.
La transformation offre la possibilité d'augmenter la variabilité génétique, cependant, introduire une nouvelle information génétique dans une espèce n'équivaut pas à créer une nouvelle variété. La création de variétés transgéniques nécessite encore l'utilisation des schémas de sélection classiques par croisements sexués. De plus, il faut vérifier que les caractéristiques agronomiques de la variété transgénique obtenue restent équivalentes à celles de la variété d'origine. L'obtention d'une variété transgénique reste donc un processus long, qui permet toutefois dans certains cas de raccourcir les programmes de sélection. La création de plantes transgéniques plus tolérantes vis-à-vis des pathogènes devrait permettre de diminuer l'utilisation de pesticides et de tendre vers une agriculture plus respectueuse de l'environnement. Néanmoins, les pratiques culturales traditionnelles comme la lutte biologique resteront encore associées aux nouvelles technologies.
Ce n'est qu'en 1994 que les premières plantes transgéniques ont été commercialisées aux États-Unis. Outre les difficultés d'ordre scientifique, agronomique ou réglementaire, l'introduction d'organismes génétiquement modifiés (O.G.M.) dans la nature se heurte à certaines oppositions. Les consommateurs européens, notamment, manifestent vis-à-vis des produits qui dérivent des O.G.M. – une réaction de rejet inspirée par la crainte que ces produits ne présentent des risques encore inconnus pour la santé, l'environnement, etc. Depuis plusieurs années des programmes sont engagés, notamment au sein de l'Institut National de la Recherche Agronomique (I.N.R.A.), pour évaluer les impacts des O.G.M. sur la santé, l'agriculture et l'environnement : transfert des transgènes d'une espèce à une autre, persistance et dissémination des O.G.M. dans l'environnement, et apparition de résistances et perturbation des populations naturelles. L'introduction de plantes transgéniques dans l'agriculture devra toutefois s'accompagner de pratiques culturales raisonnées. En France, toute création ou utilisation de plantes transgéniques dans les laboratoires de recherche est soumise à une demande d'autorisation auprès de la Commission du Génie Génétique (C.G.G.). Cette règlementation est également appliquée selon les normes européennes pour l'introduction ou la commercialisation d'une nouvelle variété transgénique.