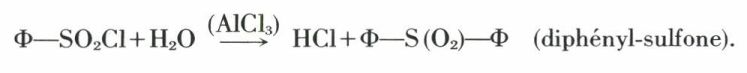sulfhydrylés (dérivés) (suite)
Les thiols sont des liquides : les termes les plus simples sont plus volatils que les alcools correspondants, car moins associés ; par contre, les termes lourds sont moins volatils que les alcools correspondants. Les thioéthers sont des liquides moins volatils que les éthers-oxydes ; ces composés sont moins solubles dans l’eau que les alcools, les phénols, les éthers-oxydes de même squelette.
Les thiols et les thiophénols possèdent une odeur nauséabonde très puissante. Bien purs, les thioéthers ont une odeur éthérée.
Les thiols et les thiophénols ont une grande analogie avec les alcools et les phénols. Ils s’en distinguent par une acidité nettement supérieure ; c’est ainsi que les thiolates RSNa prennent naissance sous l’action de la soude et sont bien moins hydrolyses que les alcoolates. HgO forme un sel (RS)2Hg, ce qui a fait donner à RSH le nom de mercaptan.
Il y a cependant deux différences essentielles.
Alors que l’oxydation permanganique des alcools porte sur le carbone, celle des thiols et des thiophénols porte sur le soufre :
R—SH + 3 O → R—SO3H ;
Φ—SH + 3 O → Φ—SO3H.
D’autre part, l’oxydation par l’iode est duplicative :
2 RSH + I2 → 2 HI + R—S—S—R (disulfure).
Les thioéthers fixent une molécule de chlore :
L’hydrolyse de ce dichlorure conduit à un sulfoxyde :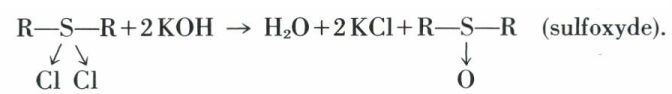
L’oxydation permanganique va plus loin et forme des sulfones :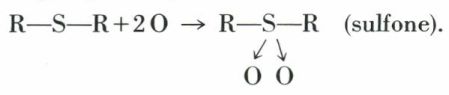
Les thioéthers s’unissent aux éthers halohydriques pour engendrer des sels de sulfonium ternaire :
R—S—R + RI → S+(R)3, I–.
Ces sels, bien cristallisés, sont transformés par Ag+, OH– en bases sulfonium ternaires :
I′.S+ (R)3 + AgOH → AgI + OH–, S+(R)3.
Ces bases, aussi fortes que la potasse, sont très solubles dans l’eau, mais thermiquement instables ; elles se décomposent, vers 130° C, comme les bases ammonium quaternaire :
OH–, (C2H5)3S+ → H2O + (C2H5)2S + CH2=CH2.
Comme le phénate de sodium, le thiophénate subit la réaction de Kolbe :
Ce dernier est un intermédiaire dans la synthèse du thio-indigo.
Thioacétals
Les thioacétals se forment par action directe des thiols sur les aldéhydes ou les cétones :
Comme les thioéthers, ils sont oxydables en sulfones :
Le sulfonal est utilisé comme hypnotique.
C. P.