pH (suite)
Ionisation de l’eau ; échelle des pH dans les solutions aqueuses
L’expérience a montré à Friedrich Kohlrausch (1894) que l’eau la plus pure est légèrement conductrice du courant : γH2O = 5,5 . 10–8 Ω–1 . m–1 à 25 °C. Cette conductivité est attribuée à des ions* qui résultent de l’action de l’eau, molécule polaire, sur elle-même. L’eau est en effet un ampholyte capable aussi bien de capter un proton fourni par un acide que de céder un proton à une base ; elle peut réagir comme base, et son acide conjugué est l’ion H3O+ ; mais elle peut aussi réagir comme acide, et sa base conjuguée est alors l’ion OH–. La présence de ces ions dans l’eau pure résulte donc de la réaction acide-base
H2O + H2O ⇄ H3O+ + OH–,
réaction pour laquelle la loi d’action de masse fournit la relation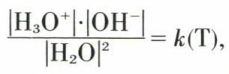
qui doit être satisfaite dans l’eau pure et les solutions aqueuses. Mais l’eau est acide ou base très faible, et la proportion des molécules H2O dissociées est toujours très petite, de sorte que |H2O| est constant dans les solutions diluées. On peut, dès lors, écrire la loi d’action de masse
|H3O+| · |OH–| = Ke (T),
produit ionique de l’eau. La valeur donnée plus haut pour γ conduit à Ke = 10–14 à 25 °C (Ke est, comme γ, une fonction rapidement croissante de la température). Dans l’eau pure à 25 °C, on a donc
|H3O+| = |OH–| = 10–7.
On définit le milieu neutre par l’égalité |H3O+| = |OH–| (qui est aussi pratiquement, en raison de la dilution, celle des molarités [H3O+] = [OH–]). Ainsi, le pH de l’eau pure est égal à 7 à 25 °C. La dissolution d’un acide dans l’eau amène la formation de nouveaux ions H3O+ par la réaction
HA + H2O ⇄ H3O+ + A–
et, par suite, la disparition d’un certain nombre d’ions OH–, et cela pour que le produit ionique de l’eau demeure inchangé. Il en résulte alors |H3O+| > |OH–|, ce qui définit un milieu acide, de pH inférieur à 7 à 25 °C. À l’inverse, la dissolution d’une base dans l’eau entraîne |OH–| > |H3O+|, ce qui définit un milieu basique, de pH supérieur à 7.
Dans un sens comme dans l’autre, vers les pH faibles ou élevés, il n’y a pas de limitation précise à l’échelle des pH. Celui-ci est nul dans une solution acide pour laquelle on a |H3O+| = 1 (ce qui est à peu près réalisé dans une solution HCl à 1,25 mole/l). Mais, si l’on ajoute encore de l’acide, le pH de la solution devient négatif. De même, dans une solution basique où l’on a |OH–| = 1, il en résulte |H3O+| = 10–14 et pH = 14 ; le pH pourrait croître encore par nouvelle addition de base. Pratiquement, cependant, il est rare que l’on ait à faire état, en solution aqueuse, de pH extérieurs à l’intervalle (0-14).
Calculs de pH de solutions aqueuses
La relation de définition théorique pH = – log |H+|, c’est-à-dire pour les solutions aqueuses pH = – log |H3O+|, ne permet pas un calcul direct du pH, car l’activité d’un ion dans une solution n’est pas directement accessible à la mesure. On sait, cependant, que, pour des solutions suffisamment diluées, l’activité diffère peu de la molarité |H3O+| = [H3O+]. Cette approximation joue un grand rôle dans les calculs de pH de ces solutions, car elle permet d’exprimer le pH en fonction de la molarité des électrolytes, grandeur aisément mesurable. On ne doit pas oublier, cependant, que les pH ainsi obtenus ne sont qu’approchés, par exemple à 0,1 unité pH, ce qui correspond à une erreur relative de l’ordre de 20 p. 100 sur [H3O+]. Remarquons, avant de donner quelques exemples de résultats de calculs de pH, que certains électrolytes dissous dans l’eau ne modifient pas pratiquement le pH de celle-ci. C’est le cas en particulier des sels d’acide fort et de base forte : leurs ions sont respectivement acide et base conjugués de base forte et d’acide fort ; donc ces ions sont pratiquement neutres et sans autre action sur l’eau que la solvatation (par exemple NaCl).
Par contre, les sels d’acide fort et de base faible (NH4Cl) libèrent par dissolution dans l’eau des cations qui sont des acides (au sens de Brønsted) de force non négligeable et qui, de ce fait, donnent avec l’eau une réaction acide-base.
le pH s’en trouve abaissé ; il en est de même, mais dans un sens inverse du précédent, des sels d’acide faible et de base forte (NaCH3—COO) ; il en est de même enfin des sels d’acide faible et de base faible, pour lesquels on peut prévoir une certaine compensation entre les effets des deux réactions acide-base sur le pH.
Voici quelques formules classiques pour des solutions :
— acide fort : pH = – log c ; base forte : pH = 14 + log c ;
— acide faible ou sel d’acide fort et de base faible :  base faible ou sel d’acide faible et de base forte :
base faible ou sel d’acide faible et de base forte : 
— sel de caractère amphotère, tel NaHCO3, hydrogénosel du diacide H2CO3, ou sel d’acide faible et de base faible : pH = (pK1 + pK2)/2 ;
— mélange équimolaire d’un acide faible et de son sel de base forte (CH3—COOH + NaCH3—COO) ou d’une base faible et de son sel d’acide fort (NH3 + NH4Cl) : pH = pKa.
Dans ces formules, c désigne la molarité de l’électrolyte en solution, et Ka la constante d’acidité du couple acide-base concerné. Toutes sont des formules approchées, valables seulement comme telles à l’intérieur d’un certain domaine de molarités et de constantes d’acidité et cela en raison du fait non seulement de la confusion des activités avec les molarités, mais encore d’approximations de calcul, nécessaires pour aboutir à des expressions simples ; c’est essentiellement leur simplicité qui justifie leur emploi.
La neutralisation progressive d’un acide par une base (ou l’inverse) s’accompagne d’une variation progressive du pH du mélange, variation que l’on peut prévoir d’une manière approchée par le calcul ou encore suivre expérimentalement à l’aide d’un appareil de mesure du pH (v. plus loin). On a reproduit (fig. 1) les graphes de variation du pH en fonction du degré d’avancement x de la réaction (x = rapport du nombre de moles de base ajoutées au nombre initial de moles d’acide) dans les deux cas suivants :
1o neutralisation d’un acide fort (HCl) par NaOH ;
2o neutralisation d’un acide faible (CH3—COOH) par NaOH.
Dans les deux cas, les molarités de l’acide et de la base sont de 1/10.




