ozone
(grec odzein, exhaler une odeur)

Gaz toxique de couleur bleutée, odorant, au pouvoir très oxydant, formé de trois atomes d'oxygène (O3).

L'ozone est naturellement présent dans la haute atmosphère, où il se forme par une réaction photochimique. Il est également produit par les étincelles électriques et les réactions chimiques libérant de l'oxygène à froid. Dans la basse atmosphère, c’est un polluant toxique pour les animaux et les plantes. Au niveau de la stratosphère, en revanche, il forme une couche protectrice de la vie sur Terre, qui absorbe les rayonnements ultraviolets du Soleil.
1. Propriétés physiques et chimiques
L'ozone est un gaz de couleur bleue, d'odeur forte et pénétrante, dangereux à respirer et plus oxydant que l'oxygène. De densité 1,66, il se liquéfie à − 112 °C en donnant un liquide bleu indigo, extrêmement instable. Il oxyde à froid l'iode et presque tous les métaux, notamment le mercure et l'argent ; il déplace le chlore, le brome et l'iode de leurs combinaisons avec l'hydrogène ou les métaux ; il oxyde au maximum les acides du soufre, du phosphore et de l'arsenic ; il détruit aussi par oxydation les matières organiques (liège, caoutchouc). En revanche, avec divers composés organiques non saturés, il donne des composés d'addition peu stables, les ozonides.
2. Utilisations
L'ozone est utilisé, pour son pouvoir oxydant et bactéricide, pour la désinfection de l'air dans les atmosphères confinées, la stérilisation des eaux, le blanchiment de textiles, le vieillissement du vin et du bois. Dans le traitement des plaies (ozonothérapie), il est appliqué en jet ou en solution aqueuse, en une ou en plusieurs fois selon le résultat obtenu. Il sert à la préparation d'huiles siccatives et à la synthèse de certaines essences végétales.
3. L'ozone atmosphérique
3.1. L’ozone stratosphérique et les bienfaits de la couche d’ozone
L'ozone joue un rôle fondamental dans les équilibres de l'environnement terrestre. 90 % de l'ozone atmosphérique se situent à des altitudes comprises entre 20 et 50 km. Cette « couche d'ozone » explique l'existence, à ces mêmes altitudes, d'une région de grande stabilité vis-à-vis des échanges verticaux, la stratosphère. Bien qu'il soit un constituant minoritaire de l'atmosphère (sa concentration relative maximale observée à 25 km d'altitude ne dépasse pas 5 à 6 millionièmes en volume), l'ozone est l'unique absorbant du rayonnement solaire ultraviolet de longueurs d'onde comprises entre 240 et 300 nanomètres. Cette absorption permet le maintien de la vie animale et végétale sur la Terre, en éliminant les radiations de courtes longueurs d'onde susceptibles de détruire les cellules de la matière vivante et d'inhiber la photosynthèse. C'est la raison pour laquelle on se préoccupe fortement depuis les années 1980 des atteintes portées à la couche d'ozone stratosphérique par les activités humaines.
3.2. L’ozone troposphérique et ses méfaits sur les êtres vivants
Aux altitudes inférieures à 10 km, les teneurs en ozone sont très faibles, de l'ordre de 0,03 millionième. Mais, contrairement à son rôle bénéfique dans la stratosphère, l'ozone agit près du sol comme un oxydant qui perturbe la photosynthèse et peut provoquer des lésions aux végétaux (taches brunes sur les feuilles correspondant à des nécroses). Dans les zones de forte pollution, où les teneurs peuvent être beaucoup plus élevées, l'ozone affecte directement la santé humaine, au niveau notamment du système respiratoire et des muqueuses. L'ozone est irritant pour les poumons, entraînant une toux, une gêne respiratoire, parfois même un œdème pulmonaire. Le traitement après une inhalation importante consiste en un repos strict, surveillé médicalement.
La quantité d'ozone contenue dans l'atmosphère s'exprime par l'« épaisseur réduite », c'est-à-dire l'épaisseur verticale d'une colonne où tout le gaz serait rassemblé, épaisseur ramenée à la température et à la pression normales. En moyenne, cette épaisseur est de 2,5 mm.
4. Le trou de la couche d'ozone
4.1. La découverte du trou de la couche d’ozone
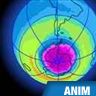
En 1985, des scientifiques britanniques signalent pour la première fois l'existence d'un « trou » de la couche d'ozone, ou plus exactement d'une réduction importante de l'épaisseur de la couche d'ozone au-dessus du pôle Sud. La haute atmosphère de cette région se révèle être en effet le théâtre d'un cycle effréné de destruction de l'ozone. Pendant l'hiver polaire, la formation d'un tourbillon d'air stratosphérique isole l'atmosphère antarctique du reste de l'hémisphère Sud. La température de la stratosphère peut alors descendre jusqu'à − 85 °C, conduisant à la formation de nuages de glace. Ces nuages polaires fixent le chlore présent dans la stratosphère sous forme d'acide chlorhydrique (HCl) et de nitrate de chlore (ClONO2). Au printemps austral, lorsque le Soleil réapparaît, en septembre et en octobre, son rayonnement provoque la dissociation du chlore par réaction photochimique. Une véritable réaction en chaîne s'enclenche alors : chaque atome de chlore libéré peut détruire jusqu'à 100 000 molécules d'ozone. Ce processus se poursuit jusqu'en novembre et réduit l'épaisseur de la couche de près de la moitié. Le Soleil a alors suffisamment réchauffé l'atmosphère pour dissiper les nuages stratosphériques. Le tourbillon polaire qui confinait le trou d'ozone disparaît, et l'air riche en ozone des latitudes moyennes s'infiltre de nouveau dans la stratosphère antarctique. Au pôle Nord, on n'assiste pas véritablement à la formation d'un tel « trou » dans la couche, mais plutôt à des déficits d'ozone localisés qui se manifestent depuis 1991. Ceci s'explique par la circulation de l'air, très différente de celle de l'Antarctique, et par des températures hivernales plus douces.
4.2. Origine et conséquences
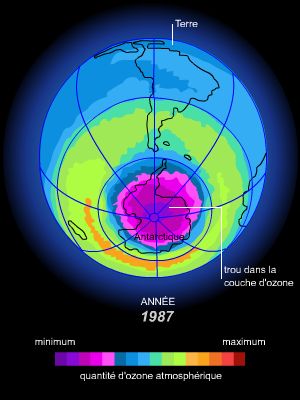
Si certains facteurs naturels, comme l'émission de gaz soufrés lors d'éruptions volcaniques, ont toujours favorisé une destruction partielle et passagère de l'ozone, les scientifiques ont dénoncé dès 1980 le danger représenté par l'émission industrielle de chlore. Les chlorofluorocarbures (CFC), utilisés comme gaz propulseurs d'aérosols, agents de réfrigération ou agents gonflants de certaines mousses rigides, constituent la cause principale de destruction de la couche d'ozone. De nombreux autres produits chimiques, notamment les halons (dérivés halogénés d'hydrocarbures), utilisés dans les extincteurs d'incendie, ainsi que certains solvants comme le tétrachlorure de carbone ou le bromure de méthyle, participent aussi à la formation du trou d'ozone. Tous ces composés, extrêmement stables, peuvent subsister entre 50 et 100 ans dans l'atmosphère. Ils diffusent ainsi jusqu'aux pôles et libèrent leurs atomes de chlore (ou de brome), qui détruisent l'ozone.
En dégradant la couche d'ozone, les activités humaines ont mis en danger notre protection solaire naturelle. La diminution de l'ozone stratosphérique entraîne l'augmentation du nombre des rayons UVB qui atteignent le sol. Ces rayons peuvent endommager l'ADN humain et provoquer notamment des cancers de la peau et des cataractes. Ils ont également un effet nocif sur les végétaux et le phytoplancton.
4.3. La prise de conscience internationale
Depuis 1985 (convention de Vienne), plusieurs conférences internationales ont marqué la prise de conscience mondiale de la nécessité de protéger la couche d'ozone stratosphérique et de veiller à limiter les effets des activités humaines sur le climat. Les principaux pays producteurs de CFC ont abandonné la fabrication et l'utilisation de ces gaz destructeurs de l'ozone. Aujourd'hui, les hydrofluorocarbures (HFC) et les hydrocarbures perfluorés (PFC), substituts de deuxième génération des CFC, sont sans danger pour la couche d'ozone (il faudra cependant des années pour qu'elle se reconstitue) ; en revanche, ce sont de puissants gaz à effet de serre qui contribuent au réchauffement de la planète.