azote
(du grec dzôê, vie)

Corps gazeux (N2) à la température ordinaire, qui constitue environ les quatre cinquièmes en volume de l'air atmosphérique. (Élément chimique de symbole N.)
- Numéro atomique : 7
- Masse atomique : 14,006 7
- Point d'ébullition : −195,8 °C
- Point de fusion : −210 °C
- Densité par rapport à l'air : 0,97
CHIMIE
Découverte de l’azote
L'azote a été découvert en 1772, par Daniel Rutherford et identifié comme corps simple par Antoine Laurent de Lavoisier en 1775. Il a également été étudié par Henry Cavendish en 1784, lors de ses travaux d’analyse de l’air.
État naturel de l’azote
L'azote existe à l'état libre dans l'air, dont il constitue environ 78 % en volume, sous forme de molécules diatomiques (diazote N2). On le trouve également combiné dans les nitrates et les sels ammoniacaux. Il entre enfin dans la constitution des protéines et des acides nucléiques des êtres vivants.
Propriétés et activité chimiques
L'azote est un gaz incolore et inodore, difficile à liquéfier et peu soluble dans l'eau. À basse température, il est sans activité chimique, d'où son nom, mais le devient à haute température, où il passe à l'état monoatomique. Certaines de ses réactions sont d'une extrême importance, à cause du rôle que jouent ses composés dans la nature et dans l'industrie. Avec l'hydrogène à chaud, il donne de l'ammoniac, par une réaction réversible. Dans l'industrie, cette réaction de synthèse est réalisée à 550 °C, sous haute pression avec un catalyseur. Avec l'oxygène, l'azote donne, dans un arc électrique, le monoxyde d'azote NO.
Préparation
Dans l'industrie, la matière première, abondante et gratuite, est l'air. Par distillation fractionnée de l'air liquide, on obtient de l'azote qui renferme un peu d'oxygène, d'argon, de l'hélium et du néon du mélange de départ. On peut également priver l'air de son oxygène en l'utilisant pour la combustion du charbon ; on obtient alors de l'azote qui contient tous les gaz rares de l'air. Cet azote atmosphérique est livré en bouteilles d'acier, sous 200 atmosphères environ. Pour obtenir de l'azote pur (azote chimique), on chauffe vers 70 °C du nitrite d'ammonium. C'est en constatant que la densité de l'azote atmosphérique et celle de l'azote chimique étaient différentes qu'on a été amené à découvrir les gaz rares.
Utilisations
Obtenu industriellement par distillation fractionnée de l'air liquide, l’azote est principalement utilisé dans la fabrication des engrais et de l'ammoniac, mais également comme atmosphère inerte dans le magasinage de liquides inflammables.
Comme liquide cryogénique, l'azote liquide a des applications alimentaires (congélation), médicales (conservation de tissus et organes, thérapie), industrielles (simulation spatiale, ébarbage, congélation des sols, etc.).
Par ailleurs, l'azote se combine avec divers métaux pour donner des nitrures ou des azotures.
Les oxydes de l'azote
Endothermiques à partir de leurs éléments, ils sont peu stables à température modérée et peuvent jouer le rôle d'oxydants.
Oxyde nitreux ou azoteux, ou protoxyde d'azote N2O
C'est un gaz incolore et inodore, assez facile à liquéfier, produisant une excitation cérébrale (gaz hilarant) puis une anesthésie. Il se décompose à la chaleur en ses éléments et peut de ce fait entretenir des combustions vives.
Monoxyde d'azote ou oxyde nitrique NO
C'est un gaz incolore, difficile à liquéfier qui se décompose complètement au rouge vif et présente alors des propriétés comburantes. Au contact de l'oxygène, il s'oxyde spontanément en donnant de l'anhydride nitreux et du peroxyde d'azote. Il réduit ainsi le permanganate de potassium, l'acide nitrique concentré, etc. Il est obtenu dans l'industrie par synthèse directe dans l'arc électrique ou par oxydation catalytique de l'ammoniac, mais est aussitôt transformé en acide nitrique ou en acide nitreux. On le nomme aussi oxyde azotique (ou dioxonitrique II).
Peroxyde ou dioxyde d’azote NO2
C'est un liquide jaune pâle qui bout à 21 °C en émettant des vapeurs rouges dont la coloration augmente par chauffage. Cela provient de l'existence de deux variétés moléculaires : dimère N2O4, incolore et stable à froid, et monomère NO2, fortement coloré et se produisant à chaud par une réaction réversible. Dès 180 °C, la molécule NO2 se dissocie en NO et oxygène. Le peroxyde d'azote présente donc des propriétés comburantes et oxydantes qui le font employer comme ergol et pour réaliser des explosifs, dénommés panclastites. Au contact de l'eau, il se comporte comme un anhydride mixte.
Anhydride nitreux N2O3
L’anhydride nitreux est obtenu à l'état liquide en mélangeant et en condensant des volumes égaux d'oxyde nitrique et de dioxyde d'azote. C'est un liquide bleu, qui bout vers 3 °C et qui se solidifie à − 102 °C. Très instable, il émet des vapeurs rutilantes, mélange de NO, de NO2 et de N2O2. Il possède à la fois les propriétés de l'oxyde nitrique et du dioxyde d'azote, c'est-à-dire qu'il peut se comporter comme un oxydant ou comme un réducteur (oxydoréduction). C'est un anhydride vrai qui correspond à l'acide nitreux HNO2. On le nomme aussi anhydride azoteux (ou dioxonitrique III).
Anhydride nitrique N2O5
L’anhydride nitrique est préparé en déshydratant l'acide nitrique par l'anhydride phosphorique. C'est un solide blanc qui fond vers 30 °C en se décomposant. Le liquide obtenu est un mélange de N2O4 et N2O5. C'est un oxydant et un anhydride vrai. L'acide correspondant est l'acide nitrique (ou trioxonitrique V). L'anhydride nitrique est nommé aussi anhydride azotique. Les composés de l'anhydride nitrique jouent un rôle important dans l'industrie des engrais, des colorants et des explosifs.
Le cycle de l'azote
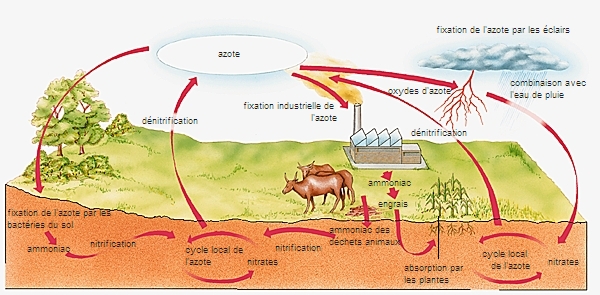

Élément essentiel des acides aminés, l'azote est l'un des quatre constituants universels de la matière vivante, avec le carbone, l'hydrogène et l'oxygène. Il constitue environ 80 % de la masse de l'atmosphère, mais seules quelques espèces vivantes dites prototrophes (bactéries libres ou symbiotiques du sol, cyanophycées) sont capables de l'absorber utilement. Les phototrophes (plantes vertes) se procurent l'azote dans l'eau ou dans le sol, surtout sous forme de nitrates. Une exception est constituée par les plantes dites enrichissantes, légumineuses surtout, qui hébergent des bactéries prototrophes dans les nodosités de leurs racines et dont l'enfouissement comme « engrais vert » enrichit le sol en azote. Les animaux utilisent l'azote contenu sous forme organique dans leurs proies animales ou végétales.
Excréments et cadavres rendent cet azote organique au sol, où une série d'actions microbiennes (ammonisation, nitrosation, nitratation) redonnent à cet élément la forme de nitrates, assimilables par les plantes. Mais des processus de dénitrification font équilibre à la fixation de l'azote dans le sol, de sorte qu'aucune évolution de la teneur de l'atmosphère en azote n'est constatée.








