liaison chimique (suite)
La liaison ionique n’est cependant possible que si, d’une part, l’atome donnant naissance au cation est à faible potentiel d’ionisation (métaux alcalins et alcalino-terreux par exemple) et si, d’autre part, l’atome fournissant l’anion possède une forte affinité électronique (halogènes, oxygène, soufre...). Les ions formés à partir des éléments cités par transfert d’un ou de deux électrons ont la configuration externe (octet) particulièrement stable des gaz inertes, desquels ces éléments sont d’ailleurs voisins dans la classification périodique. Cette règle simple, énoncée par Kossel, n’est cependant pas générale ; de nombreux métaux, appartenant en particulier aux séries de transition, y font exception.
La liaison covalente (ou atomique)
Unissant deux atomes semblables ou différents, elle résulte, suivant le schéma affirmé par Lewis, de la mise en commun de deux électrons (doublet) dont chacun est en principe fourni par chacun des atomes. C’est le cas, par exemple, de la molécule de chlore Cl2 : en ne figurant que les électrons de la couche M extérieure (couche de valence), on obtient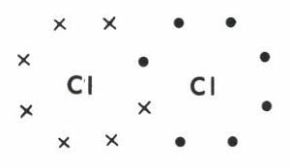
le doublet de liaison, considéré comme appartenant à l’un comme à l’autre atome, complète pour chacun d’eux l’octet du gaz inerte (argon) dont le chlore est voisin dans la classification ; cette règle de l’octet, invoquée par Lewis comme argument de stabilité de la molécule formée, n’est cependant pas généralisable au-delà de la deuxième période de la classification.
Pour simplifier l’écriture, chaque doublet, partagé ou non, peut être représenté par un tiret, et parmi eux le doublet de liaison, souvent seul représenté, unit les deux atomes ; exemples : Cl—Cl, H—Cl, H—O—H,
Il arrive que les deux électrons soient fournis par un atome (donneur), l’autre (accepteur) fournissant seulement une place pour ce doublet ; la liaison, qui présente une fois formée les caractères de la liaison covalente, est dite semi-polaire ou de coordination.
La liaison covalente est forte : les chaleurs de dissociation des molécules H2, O2, N2... sont élevées, le diamant est dur et réfractaire.
Théorie de la liaison covalente
La mécanique ondulatoire permet de justifier le rôle, a priori surprenant d’après la mécanique classique, des deux électrons échangés dans l’établissement d’une liaison covalente et de retrouver avec une bonne approximation des résultats expérimentaux concernant en particulier l’énergie et la longueur de la liaison. Le point de départ est évidemment l’équation de Schrödinger (v. atome). Il faut noter, cependant, qu’on ne sait pas encore déterminer ses solutions exactes, même dans le cas simple de la molécule d’hydrogène ; force est donc de recourir à des méthodes d’approximation. Celle de Heitler et London pour la molécule H2 considère qu’une orbitale moléculaire est obtenue par combinaison des orbitales atomiques 1s des deux atomes H. Compte tenu du principe suivant lequel les deux électrons sont indiscernables, l’approximation précédente conduit à deux fonctions d’onde ; l’une ψ+, dite symétrique et à laquelle le principe d’exclusion de Pauli fait correspondre deux électrons de spins antiparallèles ; l’autre ψ–, dite antisymétrique et dont les électrons sont de spins parallèles. Le calcul de l’énergie de l’ensemble en fonction de la distance des noyaux fait apparaître, suivant qu’on adopte l’une ou l’autre des fonctions d’onde moléculaires, pour ψ– une courbe d’énergie croissante quand la distance diminue — ce qui ne permet aucune liaison — et pour ψ+ une courbe à minimum net (fig. 1) pour une certaine distance des noyaux, minimum qui caractérise une position de stabilité pour laquelle les forces d’attraction sont exactement compensées par la répulsion des noyaux. La théorie, améliorée depuis Heitler et London, permet de retrouver avec une bonne approximation les résultats expérimentaux : longueur de la liaison H—H, 0,74 Å ; énergie de cette liaison, 4,48 eV, c’est-à-dire 103,2 kcal/mole.
L’orbitale ψ+, dite liante, correspond à une forte probabilité de présence des électrons de liaison dans l’espace situé entre les noyaux autour de la droite de leurs centres : c’est en effet à la condition d’être la plupart du temps entre les noyaux que les électrons peuvent servir de lien. L’orbitale ψ–, dite antiliante, correspond au contraire à une faible probabilité de présence des électrons entre les noyaux.
D’une façon générale, une orbitale moléculaire liante est le résultat du recouvrement de deux orbitales atomiques incomplètement occupées : par exemple deux orbitales 1s pour H2, deux orbitales 2p pour Cl2, une orbitale 1s et une orbitale 3p pour HCl. Dans tous ces cas, l’orbitale moléculaire saturée ainsi formée présente la symétrie de révolution autour de la droite des centres (fig. 2). On dit d’une telle liaison formée par recouvrement axial que c’est une liaison σ ; elle est la règle dans le cas d’une liaison simple entre deux atomes. Dans le cas d’une liaison double ou triple, la première liaison est une liaison σ, mais alors la deuxième et la troisième liaison ne peuvent résulter que d’un recouvrement latéral d’orbitales atomiques p par exemple ; l’orbitale ainsi formée présente seulement une symétrie plane (fig. 3) ; c’est une liaison π ; son énergie est moindre que celle de la liaison σ.

La liaison réelle
C’est seulement dans des cas particuliers, tel celui de la molécule diatomique d’un corps simple, que l’orbitale moléculaire de liaison est symétrique par rapport au plan médiateur de la droite des centres. Dans le cas plus général où les deux atomes sont de nature différente, l’attraction que ceux-ci exercent sur les électrons de la liaison n’est pas la même, et l’orbitale moléculaire de liaison s’en trouve déformée, les électrons restant plus longtemps au voisinage de celui des deux atomes qui les attire davantage. On dit de cet atome qu’il est plus électronégatif que l’autre. En se fondant sur des critères tels que l’énergie d’ionisation et l’affinité électronique, on a dressé diverses échelles, assez conventionnelles, d’électronégativité ; le tableau ci-dessus reproduit une partie de celle de Pauling. Dans le cas de la molécule HCl par exemple, Cl, plus électronégatif que H, attire davantage les électrons de la liaison ; il en résulte que le barycentre des charges négatives de la molécule, déplacé vers l’atome Cl, ne coïncide pas avec celui des charges positives, déplacé vers l’atome H ; la molécule est polaire, ce qu’on peut représenter par le schéma H → Cl, la flèche indiquant le sens du déplacement des électrons de liaison. Le dipôle  ,
, 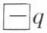 ainsi formé est caractérisé par son moment électrique dipolaire, vecteur porté par la droite des barycentres et de module μ = q . d, d étant la distance des charges
ainsi formé est caractérisé par son moment électrique dipolaire, vecteur porté par la droite des barycentres et de module μ = q . d, d étant la distance des charges  et
et 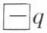 . Il est usuel d’exprimer les moments électriques des molécules au moyen de l’unité appelée debye (D) : deux charges
. Il est usuel d’exprimer les moments électriques des molécules au moyen de l’unité appelée debye (D) : deux charges  et
et  (
( étant la charge de l’électron), situées à une distance de 1 Å, constituent un dipôle dont le moment électrique vaut 4,8 D. Dans la molécule HCl, la distance des noyaux, déterminée expérimentalement, est 1,27 Å. Si HCl était de structure H+Cl–, c’est-à-dire ionique, le moment électrique de la molécule vaudrait 4,8 . 1,27 = 6,1 D. Or, la valeur expérimentale est 1,03 D. La séparation des charges dans la molécule HCl n’est donc que partielle, et on dit de cette séparation qu’elle donne à la liaison HCl un caractère ionique de 1,03 . 100/6,1 = 17 p. 100. Ce caractère, variable avec la différence d’électronégativité, est général. À noter que, même dans le cas des halogénures alcalins, où la différence d’électronégativité est la plus grande, le pourcentage ionique de la liaison n’atteint jamais 100 : la liaison ionique, dont la notion est imposée par l’existence reconnue des ions, n’existe pas à l’état pur ; que l’on parte des atomes ou des ions d’abord séparés, l’explication de la liaison chimique présente toujours les mêmes caractères : la fonction d’onde — ou orbitale — moléculaire cherchée est solution d’une équation de Schrödinger, que seule la difficulté mathématique empêche d’exprimer correctement et de résoudre analytiquement.
étant la charge de l’électron), situées à une distance de 1 Å, constituent un dipôle dont le moment électrique vaut 4,8 D. Dans la molécule HCl, la distance des noyaux, déterminée expérimentalement, est 1,27 Å. Si HCl était de structure H+Cl–, c’est-à-dire ionique, le moment électrique de la molécule vaudrait 4,8 . 1,27 = 6,1 D. Or, la valeur expérimentale est 1,03 D. La séparation des charges dans la molécule HCl n’est donc que partielle, et on dit de cette séparation qu’elle donne à la liaison HCl un caractère ionique de 1,03 . 100/6,1 = 17 p. 100. Ce caractère, variable avec la différence d’électronégativité, est général. À noter que, même dans le cas des halogénures alcalins, où la différence d’électronégativité est la plus grande, le pourcentage ionique de la liaison n’atteint jamais 100 : la liaison ionique, dont la notion est imposée par l’existence reconnue des ions, n’existe pas à l’état pur ; que l’on parte des atomes ou des ions d’abord séparés, l’explication de la liaison chimique présente toujours les mêmes caractères : la fonction d’onde — ou orbitale — moléculaire cherchée est solution d’une équation de Schrödinger, que seule la difficulté mathématique empêche d’exprimer correctement et de résoudre analytiquement.




