ion (suite)
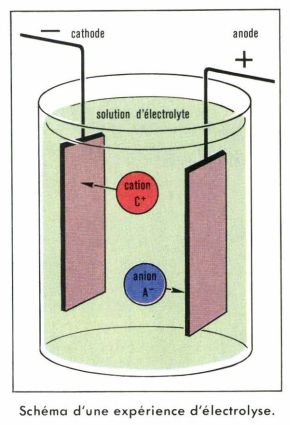
La théorie d’Arrhenius permet de calculer la conductibilité d’une solution d’électrolyte en faisant intervenir la fraction de dissociation α des molécules d’électrolyte et la mobilité λ des ions. Arrhenius suppose en effet que la réaction de dissociation de la molécule AC dans la solution est soumise aux lois générales des équilibres chimiques :
AC ⇄ An– + Cn+,
et que la loi d’action de masse s’y applique avec toutes ses conséquences. On en déduit qu’une fraction α des molécules se trouve dissociée en ions et qu’une fraction 1 – α reste sous forme de molécules. La fraction α dépend de la concentration et de la température et peut être mesurée par d’autres techniques (ébullioscopie et cryoscopie), totalement indépendantes de l’électrolyse. Avec certains électrolytes, α est toujours voisin de 1 ; on dit que ce sont des électrolytes forts. Avec d’autres électrolytes, α est toujours petit devant l’unité ; ce sont des électrolytes faibles.
La mobilité d’un ion est le coefficient de proportionnalité λ entre la vitesse moyenne v avec laquelle cet ion se déplace et le champ électrique E auquel il est soumis à l’intérieur du voltamètre, et sous l’action duquel il se déplace : v = λ E. La théorie d’Arrhenius n’est valable qu’en première approximation lorsque les interactions entre ions ne sont pas trop fortes, c’est-à-dire lorsque leur concentration est suffisamment faible (solutions diluées ou bien électrolytes faibles) ; mais dans cette limite les mesures de conductibilité des électrolytes conduisent à la détermination de leurs mobilités. Si l’on extrapole à l’ion supposé sphérique les lois du frottement visqueux dans les fluides, on peut calculer le rayon r de cette sphère. On obtient ainsi des rayons ioniques de l’ordre de l’ångström : c’est bien l’ordre de grandeur des dimensions atomiques mesurées par d’autres méthodes.
On peut comparer le rayon ionique r ainsi mesuré dans une solution avec le rayon du même ion tel qu’on peut le mesurer à l’état solide dans un cristal ; dans de nombreux cas, le rayon mesuré en solution est nettement supérieur. On explique cela par le fait que certains ions peuvent attirer plusieurs molécules d’eau, qui leur restent attachées et se déplacent avec eux, formant ainsi un groupement plus volumineux ; c’est le phénomène de solvatation des ions, particulièrement important pour les cations métalliques. D’autres techniques de mesure permettent de confirmer ce phénomène : le nombre de molécules attachées à un ion serait fréquemment supérieur à la dizaine.
Notons le rôle très particulier joué par les deux ions H+ et OH–, parce que leur mobilité est exceptionnellement élevée et qu’ils sont toujours présents dans l’eau (v. pH).
Les ions se manifestent aussi dans les gaz, où les atomes et molécules neutres peuvent perdre un ou plusieurs électrons sous l’action de différentes causes :
1o un champ électrique très intense ; c’est ainsi qu’on explique l’effluve observé à l’extrémité d’une pointe conductrice portée à un potentiel élevé, et au voisinage de laquelle règne un champ électrique intense (pouvoir des pointes en électrostatique) ;
2o des collisions avec des particules de haute énergie qui traversent le gaz : électrons accélérés à grande vitesse dans les tubes cathodiques ou les sources d’ions courantes ; rayons α, β ou γ émis par les corps radio-actifs ; les rayonnements radioactifs causent des dégâts biologiques précisément parce qu’ils produisent des ions dans les cellules vivantes et perturbent ainsi leur fonctionnement ; l’observation des rayons α, β, γ repose également sur leurs propriétés ionisantes, que ce soit dans une chambre* d’ionisation (où l’on recueille simplement les ions produits), dans un compteur* Geiger (où les ions produits provoquent une décharge électrique) ou dans une chambre* de Wilson (où les ions formés le long de la trajectoire de la particule provoquent la condensation des gouttelettes liquides observables) ;
3o un rayonnement lumineux ultraviolet ; c’est le phénomène de photo-ionisation. Ce phénomène est particulièrement intense dans la partie la plus haute de l’atmosphère (plusieurs centaines de kilomètres) appelée ionosphère* : l’atmosphère très raréfiée qui règne à ces altitudes se trouve très fortement ionisée par la partie ultraviolette du rayonnement solaire.
On peut mesurer par différentes méthodes l’énergie que la cause ionisante doit fournir à l’atome neutre d’un gaz pour lui arracher un électron ; c’est ce qu’on appelle l’énergie d’ionisation de l’atome. Cette énergie d’ionisation est caractéristique de chaque élément ; elle varie entre quelques électrons-volts pour les atomes alcalins (Li, Na, K, Rb, Cs), les plus faciles à ioniser, et 25 électrons-volts pour l’atome d’hélium, qui est le plus difficile à ioniser.
Les ions positifs formés dans les gaz raréfiés peuvent être facilement identifiés si on les soumet à l’action d’un champ électrique E et d’un champ magnétique B suivant la méthode appliquée primitivement aux électrons par J. J. Thomson et qui permet la détermination du rapport  de la charge q à la masse m de l’ion. Le perfectionnement de cette méthode a conduit à la fabrication des spectrographes* de masse, qui permettent la mesure précise des masses m des ions. On peut également identifier les ions par les méthodes de la spectroscopie optique : les raies spectrales émises par les ions lorsqu’ils sont excités par les collisions dans une décharge sont totalement différentes de celles des atomes neutres correspondants ; elles sont également distinctes suivant le nombre d’électrons qui ont été arrachés à l’atome. On notera le rôle particulier joué en spectroscopie par les ions hydrogénoïdes He+, Li++, Be+++, etc., dans lesquels un seul électron reste lié au noyau et dont le spectre, pour cette raison, présente beaucoup de points communs avec celui de l’atome d’hydrogène.
de la charge q à la masse m de l’ion. Le perfectionnement de cette méthode a conduit à la fabrication des spectrographes* de masse, qui permettent la mesure précise des masses m des ions. On peut également identifier les ions par les méthodes de la spectroscopie optique : les raies spectrales émises par les ions lorsqu’ils sont excités par les collisions dans une décharge sont totalement différentes de celles des atomes neutres correspondants ; elles sont également distinctes suivant le nombre d’électrons qui ont été arrachés à l’atome. On notera le rôle particulier joué en spectroscopie par les ions hydrogénoïdes He+, Li++, Be+++, etc., dans lesquels un seul électron reste lié au noyau et dont le spectre, pour cette raison, présente beaucoup de points communs avec celui de l’atome d’hydrogène.
Les ions jouent aussi un grand rôle dans la structure de l’état solide, puisqu’un grand nombre de substances (en particulier tous les sels minéraux) forment des cristaux ioniques : empilements réguliers d’ions alternativement négatifs et positifs.
L’énergie électrostatique d’interaction entre ces ions permet d’expliquer leur cohésion. De faibles déplacements des ions par rapport à leur position d’équilibre permettent d’expliquer les propriétés diélectriques de ces cristaux et, dans certains cas particuliers comme le quartz, les propriétés piézo-électriques.
B. C.