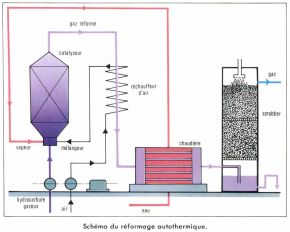
gaz (suite)
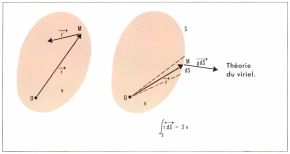
Voici par exemple l’interprétation de la pression d’un gaz. Soit O un point fixe origine, M la position d’une molécule du gaz au temps t. Si l’on pose 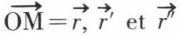 sont respectivement vitesse et accélération de la molécule au temps t ;
sont respectivement vitesse et accélération de la molécule au temps t ; 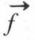 étant la force appliquée à cet instant à la molécule de masse m, on a :
étant la force appliquée à cet instant à la molécule de masse m, on a : 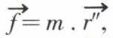 ou, en multipliant scalairement par
ou, en multipliant scalairement par 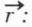
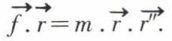
Or, si on dérive deux fois 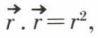 on a :
on a :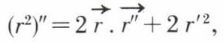
d’où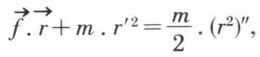
égalité que l’on peut étendre à l’ensemble des molécules du gaz au temps t :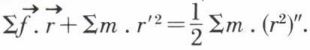
La répartition des molécules dans le volume occupé par un gaz en équilibre thermique étant uniforme et indépendante du temps, Σ(r2) est une constante, dont les dérivées sont nulles ; d’où :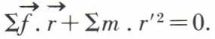
La quantité 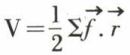 est le viriel des forces appliquées aux molécules du gaz (Clausius). L’égalité
est le viriel des forces appliquées aux molécules du gaz (Clausius). L’égalité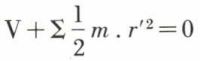
traduit le théorème du viriel : l’énergie cinétique totale de translation des molécules est égale à chaque instant au viriel des forces appliquées, changé de signe. Supposons nulles les actions intermoléculaires : les seules forces appliquées sont alors les actions de contact lors des chocs sur les parois, auxquelles sont opposées les forces de pression du gaz ; on a donc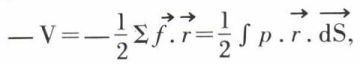
somme étendue à la surface S qui limite le volume v du gaz ; or, on voit immédiatement que l’on a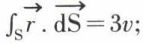
on a donc 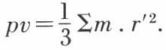 Supposons une mole des gaz, soit M sa masse ; désignons par
Supposons une mole des gaz, soit M sa masse ; désignons par 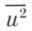 la moyenne des carrés des vitesses
la moyenne des carrés des vitesses 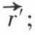 on a
on a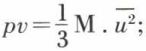
le produit pv est égal aux 2/3 de l’énergie cinétique moyenne de translation des molécules du gaz.
La comparaison avec l’équation d’état du gaz parfait pv = RT montre alors que la température 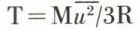 est proportionnelle à l’énergie cinétique moyenne de translation des molécules ; elle permet aussi une évaluation de la vitesse (quadratique moyenne)
est proportionnelle à l’énergie cinétique moyenne de translation des molécules ; elle permet aussi une évaluation de la vitesse (quadratique moyenne)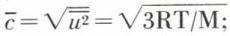
pour O2 à 27 °C, on a
résultat vérifié par l’expérience, et d’autant plus remarquable qu’il a été obtenu très simplement.
Cette vitesse est, on le voit, inversement proportionnelle à 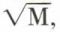 donc à
donc à 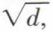 d étant la densité du gaz ; ce résultat rappelle la loi de Graham, d’après laquelle la vitesse d’effusion d’un gaz à travers un très petit orifice est inversement proportionnelle à la racine carrée de sa densité.
d étant la densité du gaz ; ce résultat rappelle la loi de Graham, d’après laquelle la vitesse d’effusion d’un gaz à travers un très petit orifice est inversement proportionnelle à la racine carrée de sa densité.
R. D.
➙ Chaleur massique / Coefficients thermodynamiques / Compresseur / Détente / Dilatation / Entropie / Potentiels thermodynamiques / Température / Thermodynamique / Vaporisation.
A. Ricci, l’État gazeux (P. U. F., coll. « Que sais-je ? », 1949, 2e éd. 1969). / E. Bloch, Théorie cinétique des gaz (A. Colin, 1951).
Deux savants
Émile Hilaire Amagat,
physicien français (Saint-Satur, Cher, 1841 - id. 1915). Il est l’auteur de travaux sur la statique des fluides (compressibilité et dilatation) et sur les variations des points de fusion avec la pression. (Acad. des sc., 1902.)
Joseph Loschmidt,
physicien autrichien (Putschirn, Bohême, 1821 - Vienne 1895). En étudiant la diffusion des gaz et en mesurant le libre parcours moyen, il a calculé une première valeur du nombre des molécules existant dans un volume donné de matière.