aluminium (suite)
L’ammoniaque donne avec un sel d’aluminium en solution aqueuse un précipité d’hydroxyde très peu soluble dans l’eau et qui est amphotère, c’est-à-dire qui peut se comporter, suivant les circonstances, comme une base faible ou un acide faible. Cela correspond à une ionisation de la très faible quantité d’hydroxyde d’aluminium dissoute, selon le schéma suivant :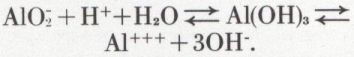
Le chlorure d’aluminium est un catalyseur utilisé en chimie organique. Il s’hydrolyse très fortement en présence d’eau. Le sulfate est le sel le plus important. Il est capable de donner naissance à une famille de sels doubles, les aluns, de formule générale
M2SO4, M′2(SO4)3, 24 H2O,
où M est un ion monovalent comme K+, Rb+, Cs+ ou l’ion NH4+ et où M′ est un cation trivalent comme l’est lui-même le cation aluminium Al+++.
On connaît de nombreux silicates d’aluminium. Enfin, l’aluminium est l’objet d’une très importante industrie, et on l’obtient par électrolyse, vers 1 000 °C, d’un bain fondu de cryolithe Na3AlF6, d’alumine Al2O3 et de fluorine CaF2. L’aluminium obtenu à la cathode est ensuite raffiné par voie électrochimique selon le procédé de l’anode soluble.
H. B.
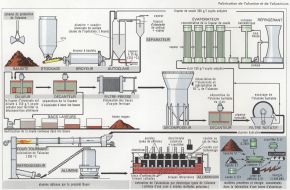
Élaboration du métal
La bauxite est une alumine hydratée, dont la variété rouge, extraite pour les emplois métallurgiques, est composée de 50 à 60 p. 100 d’alumine, de 3 à 5 p. 100 de silice, de 2 à 4 p. 100 d’oxyde de titane et de 20 à 30 p. 100 d’oxyde de fer, qui lui confère sa couleur.
En raison de la grande oxydabilité du métal, il est difficile d’appliquer une méthode classique d’obtention d’un métal ou d’un concentré impur et de le purifier. Le procédé utilisé consiste à obtenir de l’alumine très pure et de la traiter par électrolyse pour en extraire le métal. Parmi les différents procédés de purification de l’alumine, le procédé Bayer est le plus généralisé mondialement. Après broyage et séchage, la bauxite est attaquée pendant plusieurs heures, à 200 °C, dans des autoclaves sous pression, par une solution de soude caustique. On sépare de la solution d’aluminate de sodium ainsi formée les impuretés insolubles, qui forment des boues rouges constituées de silice, d’oxyde de fer, d’oxyde de titane et d’alumine, entraînée partiellement. Par action de l’eau dans des cuves appropriées, ou décomposeurs, l’aluminate est décomposé en soude, qui est récupérée, et en trihydrate d’aluminium. Après filtration et lavage, ce dernier subit une calcination dans un four rotatif à 1 200 °C, qui conduit à une alumine anhydre pure à 99,5 p. 100. Dans une seconde phase, on procède à une électrolyse ignée de l’alumine anhydre pure. Le bain de sels fondus à 950 °C. constituant l’électrolyte, est composé de 7 à 10 p. 100 d’alumine dissoute dans la cryolithe, fluorure double d’aluminium et de sodium, dont les principaux gisements sont au Groenland. Bien qu’elle provienne de réactions secondaires complexes, la décomposition électrolytique de l’alumine se résume à la réaction
Al2O3 → 2 Al+ 3/2 O2.
L’opération se pratique dans des cuves électrolytiques dont le fond, rendu conducteur, constitue la cathode, où se dépose l’aluminium fondu, recouvert d’un bain de sels ayant une masse volumique inférieure à celle de l’aluminium fondu à cette température de travail. L’oxygène dégagé réagit avec des anodes carbonées très pures, à base de coke de pétrole mélangé de brai : d’où un dégagement de gaz carbonique et d’oxyde de carbone.
4 t bauxite → 2 t alumine anhydre → 1 t aluminium (consommation de 14 000 kWh d’électricité).
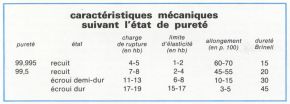
Le métal extrait des cuves d’électrolyse titre 99,8 p. 100. Pour de nombreuses applications exigeant une excellente tenue à la corrosion chimique, pour l’élaboration de certains alliages, pour la fabrication de placage, etc., il est nécessaire de pratiquer un raffinage de l’aluminium. Les procédés classiques, soit thermique, soit d’électrolyse en solution aqueuse, ne pouvant être appliqués en raison de la réactivité du métal, on a recours à l’électrolyse ignée. Dans le procédé original de Gadeau, dit « à trois couches », la cuve d’électrolyse contient au fond, constituant l’anode, la couche d’aluminium fondu à raffiner, dont la masse volumique est augmentée par addition de 30 p. 100 de cuivre. Cette couche anodique est surmontée d’une couche d’électrolyte à base de fluorures et de chlorures ; en surface se dépose la couche cathodique d’aluminium raffiné, qui titre 99,99 p. 100.
Propriétés et applications de l’aluminium pur
Les principales propriétés qui permettent ses emplois industriels sont :
— sa faible masse volumique, de 2,7 g/cm3 ;
— sa haute conductibilité électrique, voisine de celle du cuivre, qu’il concurrence dans de nombreuses applications de transport d’électricité ;
— sa haute conductibilité thermique, proche de celles de l’argent, du cuivre ou de l’or ;
— sa bonne tenue à la corrosion atmosphérique par suite de la formation d’un film autoprotecteur continu d’alumine ;
— son pouvoir réfléchissant élevé, de l’ordre de 90 p. 100 pour le rayonnement calorifique ;
— son point de fusion modéré, facilitant l’élaboration des alliages ;
— ses caractéristiques mécaniques de grand allongement et de faible résistance à la rupture à l’état recuit, ce qui permet son formage par laminage, emboutissage, étirage, tréfilage, etc.
La combinaison des diverses propriétés explique l’utilisation de l’aluminium extra-pur ou de pureté dite « commerciale » pour le bâtiment (toitures, éléments décoratifs ou de protection), l’industrie aéronautique, la construction mécanique, l’industrie électrique, le matériel de transport, l’emballage et le matériel culinaire.
Les alliages d’aluminium ou alliages légers
Les alliages d’aluminium avec des métaux tels que le cuivre, le silicium, le magnésium, le zinc sont très nombreux et s’emploient soit sous forme moulée de fonderie, soit sous forme de produits corroyés par forgeage, filage, laminage, matriçage, étirage. Certains de ces alliages sont susceptibles de subir des traitements thermiques, particulièrement par durcissement structural ou vieillissement.




