équation d’état
Relation entre des grandeurs qui définissent l’état d’une masse donnée d’un corps pur.
Généralités
Si l’on fait abstraction de la réalité moléculaire et que l’on ne considère, pour un échantillon de substance dont les dimensions sont accessibles à nos sens, que l’aspect macroscopique, l’expérience montre qu’un état d’équilibre peut être entièrement précisé par la connaissance des valeurs que prennent, pour cet état de l’échantillon, un nombre de grandeurs habituellement petit. En particulier, pour une masse donnée d’un corps pur à l’état de fluide homogène, il est suffisant, pour caractériser chaque état d’équilibre, de préciser volume, pression et température. Et encore ces trois grandeurs, qui varient d’un état à un autre, ne sont-elles pas indépendantes : le volume est déterminé si on se donne pression et température ; c’est dire qu’il existe, pour cette masse de ce fluide, une relation f (p, v, T) = 0, qu’on appelle son équation d’état, celle-ci étant, dans sa forme, caractéristique du fluide considéré.
La connaissance de l’équation d’état pour un fluide est importante. Elle permet le calcul a priori, sans qu’il soit nécessaire de recourir à l’expérience, de l’une des trois grandeurs p, v, T quand on se donne les deux autres ; mais aussi elle apporte une aide précieuse au calcul de nombreuses grandeurs caractéristiques du fluide ainsi que de leurs variations (v. coefficients thermodynamiques).
Recherche de l’équation d’état d’un gaz
C’est une constatation déjà ancienne que celle de l’unité de comportement des différents gaz : l’étude de la compressibilité, faite par Boyle* et par Mariotte, celle de la dilatation, faite par Gay-Lussac*, ont conduit à l’idée d’une même équation d’état pour tous les gaz. Si les propriétés traduites par les lois de Mariotte et de Gay-Lussac étaient exactement satisfaites, l’équation d’état d’un gaz serait de la forme pv = p0v0 (1 + αt), ou, en introduisant la température absolue  pv = p0v0αT, où α est le coefficient de dilatation du gaz, p0 et v0 sa pression et son volume à 0 °C. Il n’existe pas de gaz réel qui obéisse exactement à ces lois simples ; il est cependant commode de conserver l’équation précédente comme première approximation. C’est une des raisons pour lesquelles on a créé ce modèle, qu’on appelle le gaz* parfait, associé au gaz réel ; sa définition est telle que son équation d’état est, pour n moles : pv = nRT ; R est une constante universelle, de valeur 8,314 J/K/mole. Cette équation d’état cesse d’être applicable au gaz réel, même comme grossière approximation, quand on s’approche des conditions de la liquéfaction ; il a donc été nécessaire de rechercher une équation d’état mieux adaptée au gaz réel.
pv = p0v0αT, où α est le coefficient de dilatation du gaz, p0 et v0 sa pression et son volume à 0 °C. Il n’existe pas de gaz réel qui obéisse exactement à ces lois simples ; il est cependant commode de conserver l’équation précédente comme première approximation. C’est une des raisons pour lesquelles on a créé ce modèle, qu’on appelle le gaz* parfait, associé au gaz réel ; sa définition est telle que son équation d’état est, pour n moles : pv = nRT ; R est une constante universelle, de valeur 8,314 J/K/mole. Cette équation d’état cesse d’être applicable au gaz réel, même comme grossière approximation, quand on s’approche des conditions de la liquéfaction ; il a donc été nécessaire de rechercher une équation d’état mieux adaptée au gaz réel.
On remarque d’abord que le volume d’un gaz réel ne peut tendre vers zéro quand la pression augmente, cela à cause du volume propre des molécules ; l’équation d’état du gaz parfait doit donc être modifiée en y remplaçant v par v – b ; b est dit « covolume ». On remarque ensuite que, contrairement aux molécules du gaz parfait, qui n’ont entre elles aucune action en dehors des chocs, celles du gaz réel s’attirent mutuellement ; la pression p observée est donc inférieure à celle p′ qu’exercerait le gaz si ces actions intermoléculaires n’existaient pas, ce qu’on écrit : p = p′ – π ; π est dit « pression interne ». L’équation d’état du gaz parfait doit donc être modifiée en y remplaçant la pression par p + π. Cela donne, pour la mole du gaz (p + π) (v – b) = RT. Des considérations d’ordre théorique ont conduit J. D. Van der Waals (1837-1923) à admettre pour la pression interne une expression de la forme : π = a/v2, a étant une constante pour la mole d’un gaz donné ; l’équation (p + a/v2) (v – b) = RT, dite « de Van der Waals » (1873), où a, b, R sont des constantes relatives à la mole, est remarquable, eu égard à sa simplicité, en ce qu’elle permet de prévoir certaines propriétés du gaz ; parmi celles-ci, l’existence d’une isotherme critique et d’un point critique dont les coordonnées sont calculables en fonction de a, b, R ; un minimum du produit pv à température constante, dans un domaine de températures limitées supérieurement par la température dite « de Mariotte », calculable elle aussi en fonction de a, b, R.
L’expérience contredit cependant certaines conséquences de l’équation de Van der Waals : ainsi, cette équation prévoit que, si on laisse constant le volume, la pression est fonction linéaire de la température ; autrement dit, les isochores du gaz sont des droites, ce que contredit l’expérience (le thermomètre à gaz à volume constant ne définit pas, quels que soient le volume et le gaz, l’échelle légale de températures). Pour améliorer l’accord avec l’expérience, de nombreuses autres équations d’état ont été proposées. Certaines ne diffèrent de l’équation de Van der Waals que par l’expression, plus compliquée, de la pression interne : celle de Clausius, qui pose  celle de Berthelot qui, β étant ordinairement très petit, a proposé
celle de Berthelot qui, β étant ordinairement très petit, a proposé 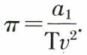 D’autres s’en écartent davantage, comme celle de C. Dieterici
D’autres s’en écartent davantage, comme celle de C. Dieterici
p(v – b) . ea′/RTv = RT,
et celle, plus récente (1927), de J. A. Beattie et O. C. Bridgeman
pv2 = RT(1 – є) (v + B) – A,
avec 
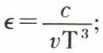 c’est une équation qui comprend six constantes ; elle est d’un maniement compliqué, mais l’accord avec l’expérience est excellent dans un domaine étendu. Enfin, on obtiendra toute la précision désirable avec l’équation dite « du viriel » (H. Kamerlingh Onnes*)
c’est une équation qui comprend six constantes ; elle est d’un maniement compliqué, mais l’accord avec l’expérience est excellent dans un domaine étendu. Enfin, on obtiendra toute la précision désirable avec l’équation dite « du viriel » (H. Kamerlingh Onnes*)
à condition d’utiliser un nombre suffisant de coefficients du viriel.
Équation d’état réduite, états correspondants
Un certain nombre d’équations d’état, dont celle de Van der Waals, renferment trois constantes. Il en résulte que, puisque par exemple les coordonnées critiques pc, Tc, vc du gaz peuvent s’exprimer en fonction des trois constantes de l’équation d’état, inversement, ces trois constantes peuvent être exprimées à l’aide de pc, Tc, vc ; le remplacement dans l’équation d’état des constantes par leurs expressions en fonction de pc, Tc, vc conduit à une équation f(p, v, T, pc, vc, Tc) = 0, homogène en p et pc, T et Tc, v et vc, et qui par suite ne dépend que des rapports p/pc = ω, T/Tc = θ, v/vc = φ ; c’est ainsi que, pour l’équation de Van der Waals, ce remplacement conduit à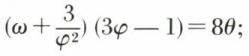
cette équation, qui ne contient plus que des constantes numériques, et qui par suite est la même pour tous les gaz, est dite « équation réduite de Van der Waals » ; ω, θ, φ sont respectivement pression, température, volume réduits.




