eau (suite)
Mécanismes régulateurs
Ils jouent sur les entrées (boissons) et les sorties (urine).
• La soif commande les apports. Le facteur humoral est déterminant : c’est la déshydratation cellulaire, entraînant l’élévation du gradient osmotique. Le contrôle central se fait au niveau de l’hypothalamus, où se trouvent des osmorécepteurs, peut-être différents de ceux qui règlent la sécrétion de l’hormone antidiurétique. La sécrétion salivaire diminue, d’où la sécheresse buccale, qui n’est d’ailleurs pas le seul facteur de la soif.
• Le rein règle les sorties d’eau. L’eau, excrétée en grande quantité au niveau des glomérules, est réabsorbée au niveau des tubules du néphron (v. diurétique et rein). La majeure partie de l’eau est réabsorbée de manière obligatoire. Il existe en outre une réabsorption facultative au niveau du tubule rénal distal et du tube collecteur. Le volume d’eau réabsorbé dépend d’un contrôle neuro-endocrinien (hormone antidiurétique, aldostérone).
• L’hormone antidiurétique (sécrétée par le lobe postérieur de l’hypophyse) augmente la perméabilité à l’eau du tube collecteur. Elle permet l’équilibration osmotique. Sa sécrétion est commandée par les osmorécepteurs et les volorécepteurs (contrôlant le volume de la masse sanguine).
• L’aldostérone (sécrétée par la corticosurrénale) commande la réabsorption du sodium au niveau du tube distal du néphron, et ainsi elle accroît l’osmolarité du milieu intérieur. Elle intervient donc, par l’intermédiaire du sodium, dans le métabolisme hydrique, assurant en particulier la stabilité de la volémie (volume sanguin total).
La régulation des compartiments
Entre les secteurs plasmatiques et interstitiels, au niveau des capillaires, les mouvements de l’eau dépendent d’un processus de diffusion ainsi que de l’équilibre entre la pression oncotique (qui retient l’eau) et la pression de filtration (qui la fait sortir).
Entre les compartiments extra-cellulaire et cellulaire, l’eau passe à travers la membrane, par diffusion, dans les deux sens, selon l’état osmotique des compartiments.
Pathologie
L’existence d’un gradient osmotique entre les compartiments hydriques explique un déséquilibre éventuel, qui peut revêtir plusieurs aspects :
— déshydratation extra-cellulaire par déperdition d’eau et de sodium ;
— déshydratation cellulaire par surcharge sodée pure ;
— hyperhydratation extra-cellulaire par surcharge d’eau et de sodium (insuffisance cardiaque, rénale, cirrhose avec œdèmes) ;
— hyperhydratation cellulaire par perte isolée de sel.
Le métabolisme hydrique, complexe, réglé par de nombreux mécanismes, est inséparable du métabolisme des électrolytes (sodium, potassium) ; il est perturbé dans de nombreuses maladies.
P. V.





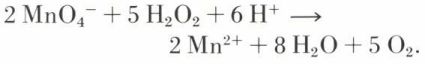
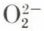 s’appelle anion peroxyde.
s’appelle anion peroxyde.