dicarbonylés (dérivés) (suite)
Propriétés chimiques
Les propriétés spécifiques du carbonyle sont peu affectées par le voisinage de deux tels groupes, ce qui revient à dire que les dicarbonylés-α subissent deux fois, et successivement, les transformations fonctionnelles du carbonyle ; à titre d’exemple, l’action de l’hydroxylamine en excès sur le diacétyle conduit à une dioxime
appelée diméthylglyoxime, réactif de l’ion Ni++.
Les dicarbonylés-α sont, plus ou moins facilement, dégradés par oxydation en deux acides :
R—CO—CO—R′ + O + H2O → R—COOH + R′—COOH.
La potasse concentrée transforme les dicarboxylés-α en sels d’acide α-alcool :
Mais l’intérêt des dicarbonylés-α réside dans plusieurs types de cyclisations :
a) la déshydratation d’une dicétone R—CO—CO—CH2—R′ conduit (entre autres choses) à une quinone :
b) sa condensation avec l’orthophénylène-diamine engendre un hétérocycle appelé quinoxaline :
c) en présence d’un aldéhyde, l’ammoniac conduit à une glyoxaline ou à une imidazole :
Les dicétones Φ—CH2—CO—CO—R sont particulières ; jaunes et généralement liquides sous cette forme, elles s’isomérisent réversiblement en formes « énoliques », stabilisées par conjugaison :
Ces formes énoliques, moins volatiles que la forme dicétonique, sont incolores et généralement solides.
Dicarbonylés-β
Préparations
Presque toutes dérivent de la réaction de Claisen (condensation d’une cétone et d’un ester en présence de C2H5ONa) :
Propriétés physiques
Ce sont en général des liquides, bouillant mal dans les conditions ordinaires ; il existe en effet un équilibre :
L’énol est stabilisé par liaison hydrogène interne (chélation). L’équilibre est déplacé en fonction de la température et du solvant ; dans l’exemple choisi, il correspond, à la température ordinaire et en l’absence de solvant, à 90 p. 100 environ de forme énolique. Cet équilibre s’établit lentement en l’absence de catalyseur, mais très rapidement sous l’influence des ions H+ ou OH−.
Les premiers termes sont assez solubles dans l’eau ; tous sont incolores. Contrairement à ce qui se passait pour les dicétones-α, la forme énolique (chélatée) est plus volatile que la forme cétonique.
Propriétés chimiques
En l’absence d’hydrogène sur le carbone compris entre les deux groupes carbonyle, les propriétés fonctionnelles des cétones sont en principe conservées, mais beaucoup sont masquées par l’instabilité :
Comme nous l’allons voir, cette dégradation constitue un accès facile aux monocétones.
Mais, si le carbone médian est lié à au moins un atome d’hydrogène, celui-ci est « mobile » dans tous les sens que l’on peut donner à ce mot ; nous venons de voir qu’il peut se déplacer ; ajoutons qu’il est particulièrement vulnérable à l’action des halogènes, de l’acide nitreux et, fait nouveau, à celle des diazoïques :
Le groupe CH2 donne facilement les réaction des monocétones à radicaux non tertiaires ; cétolisation, crotonisation, etc.
Mais le caractère essentiel est l’acidité de l’un des hydrogènes du groupe —CH2— ou de celui du groupe —CH(R)—.
Des alcalis, même faibles, arrachent un proton, libérant un ion mésomère, l’ion cétoénolate :
Celui-ci peut être alcoylé par R1Br, conduisant à une dicétone alcoylée, qui peut être alcoylée de nouveau par répétition du procédé, d’où les dicétones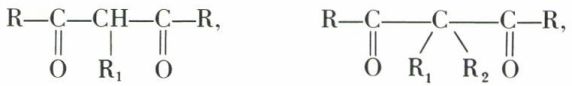
et, par dégradation alcaline, la synthèse des monocétones (voir plus haut).
Cette acidité explique l’impossibilité de condensation des deux groupes CO avec un organomagnésien ; celui-ci est détruit avec libération d’un hydrocarbure. Les dérivés azotés se cyclisent :
Dicarbonylés plus éloignés
Parmi les synthèses, deux sont assez générales : l’oxydation des glycols R—CHOH—(CH2)n—CHOH—R, la condensation des dichlorures d’acides ClCO—(CH2)n—COCl avec l’organocadmien RCdCl.
Mais les dicarbonylés-γ résultent également de l’hydrolyse indirecte des hétérocycles pentagonaux (furanne, pyrrole).
Ces dicarbonylés-γ, -δ, -ε, etc., ne présentent aucune anomalie physique et se conduisent généralement deux fois comme les monocarbonylés.
Seules quelques condensations sont intéressantes : les dicarbonylés-γ sont déshydratés en furannes, transformés par P2S5 en thiofènes et par NH3 en pyrroles ; respectivement :
Les dicarbonylés-γ et -δ et les dicarbonylés plus éloignés engendrent par crotonisation interne des cétones cycliques :
C. P.




