diacides carboxyliques (suite)
Série malonique
L’ester malonique EtOCO—CH2—CO2Et est généralement préparé à partir de l’ester cyanacétique CN—CH2—CO2Et (ClCH2—CO2Et + KCN).
Comme nous l’allons voir, il peut être alcoylé ; d’où la synthèse des homologues
L’hydrolyse prudente de ces esters conduit aux diacides correspondants, par exemple HOCO—CH(R)—COOH.
Tous les acides de la série malonique sont caractérisés par une grande instabilité ; vers 130 °C, ils se décarboxylent :
HOCO—CH(R)—CO2H → CO2 + R—CH2—CO2H.
(synthèse malonique des monoacides)
Le caractère essentiel de l’ester malonique est la grande mobilité des hydrogènes du groupe CH2 ; celle-ci permet l’alcoylation en milieu alcalin :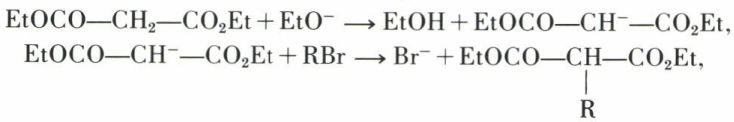
mais aussi des condensations plus complexes :
Enfin, les esters maloniques dialcoylés se condensent à l’urée pour former des dialcoylbarbituriques :
constituant les hypnotiques : véronal, allonal, gardénal, etc.
Série succinique
L’acide succinique a été découvert dans l’hydratation de son anhydride provenant de la pyrogénation de l’ambre succin (d’où son nom). Les synthèses, dont beaucoup sont généralisables aux homologues, sont nombreuses : le nitrile résulte de l’action de KCN sur le bromure d’éthylène BrCH2—CH2Br ; mais on peut également oxyder le butanediol 1,4 CH2OH—CH2—CH2—CH2OH, que l’industrie prépare par hydrogénation du butynediol
CH2OH—C≡C—CH2OH (CH≡CH + 2 HCHO).
L’acide succinique fond à 185 °C ; on en connaît tous les dérivés fonctionnels, mais le plus important est l’anhydride cyclique
obtenu par chauffage vers 200 °C ou par ébullition avec l’anhydride acétique ; il peut être réduit (Na + H2O) en trois phases (lactone, furannose, glycol) :
On connaît les deux diacides éthyléniques
Le second, résultant de la déshydratation de l’acide malique, s’isomérise par chauffage à sec en acide maléique, qui se déshydrate en anhydride maléique
Ce dernier, par hydratation prudente, conduit à l’acide maléique, mais celui-ci, en solution aqueuse, s’isomérise assez rapidement à chaud en acide fumarique, qui, moins soluble, se dépose par refroidissement ; on voit ainsi que la cis-trans conversion des acides peut être réalisée quantitativement dans l’un ou l’autre sens.
L’acide maléique s’obtient plus facilement par dégradation oxydante du phénol, de la quinone, du furanne ; son anhydride est un excellent philodiène qui s’unit aux diènes conjugués :
L’acide orthophtalique
prend naissance dans l’oxydation des benzènes portant, en ortho, deux chaînes hydrocarbonées, en particulier de l’orthoxylène, mais on prépare plus facilement son anhydride par oxydation du naphtalène (air à 450 °C en présence de V2O5).
Cet anhydride, beaucoup plus important que le diacide, est un solide fondant à 130 °C.
Il agit normalement sur les alcools pour former d’abord des monoesters :
Cette réaction est utilisée pour extraire un alcool d’un mélange et pour dédoubler un alcool racémique (on fait appel au sel de la fonction acide d’un alcaloïde actif) ; les phtalates neutres (phtalate dibutylique) sont utilisés comme plastifiants.
Avec les glycols, l’anhydride phtalique forme des superpolyesters :
Mais, avec le glycérol, cette chaîne est soudée à d’autres par action de nouvelles molécules d’anhydride sur le troisième hydroxyle : d’où un réseau tridimensionnel (c’est le principe de la préparation des glyptals, utilisés principalement comme « vernis au four »).
Avec les phénols, les diphénols méta, les dialcoylamino-phénols méta, l’anhydride phtalique engendre des matières colorées ; phtaléines, fluorescéine, rhodamines.
Avec l’ammoniac, il forme l’acide phtalamique, puis le phtalimide, respectivement
Le premier, par Br2 + KOH, est transformé en acide anthranilique (parfums, colorants) ; le second est un auxiliaire dans la préparation des aminés primaires.
Enfin, en présence de déshydratants énergiques, l’anhydride phtalique et le benzène forment l’anthraquinone, base de plusieurs excellents colorants :
Série glutarique : HOCO(CH2)3—CO2H
Nous avons rencontré un mode de synthèse (action d’un aldéhyde sur l’ester malonique).
L’acide glutarique est un solide fondant à 130 °C.
Sa propriété essentielle est de se déshydrater en un anhydride cyclique hexagonal, très comparable à l’anhydride succinique.
Acide adipique HOCO—(CH2)4—CO2H
Les dérivés de l’acide adipique résultent de nombreuses synthèses, parmi lesquelles nous nous bornerons à la formation du nitrile par action de KCN sur le dichloro-1,4 butane ou à celle d’un tétraester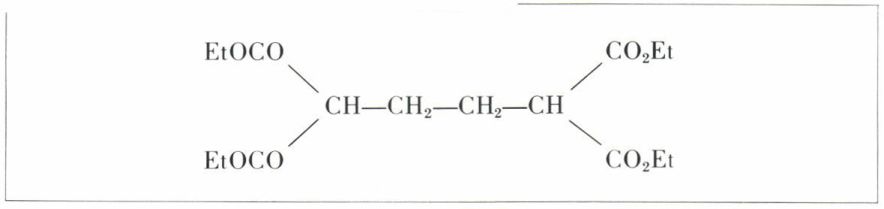
par action du bromure d’éthylène BrCH2—CH2Br sur l’ester malonique en milieu alcalin. De toute façon, on passe facilement de ces dérivés au diacide. Mais la préparation industrielle la plus pratique est l’oxydation du cyclohexanol, de la cyclohexanone ou du cyclohexène, obtenus à partir du phénol ; par exemple,
L’acide adipique ne donne plus d’anhydride cyclique ; par contre, la réaction de Piria conduit à une cyclisation :
De même, l’ester subit une réaction de Claisen interne :
Ce sont les meilleures préparations des cyclopentanones. Mais l’acide adipique a pris une importance considérable depuis la Seconde Guerre mondiale ; en effet, son nitrile peut être hydrogéné en hexaméthylène-diamine NH2—(CH2)6—NH2, et la polycondensation de l’acide et de l’amine conduit à un superpolyamide ... NH(CH2)6—NH—CO—(CH2)4—CO—NH(CH2)6 ... formant des fibres textiles appelées Nylon.




