alcools et dérivés fonctionnels (suite)
La réaction d’estérification
est lente et réversible, catalysée par l’ion H+. On a pu montrer qu’elle correspond au schéma
c’est-à-dire qu’elle se traduit, chez l’alcool, par la rupture de la liaison O—H. Elle est à peu près impraticable avec les alcools tertiaires chez lesquels cette liaison est peu mobile.
Les alcools primaires s’additionnent aux dérivés isocyaniques :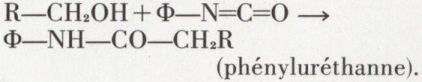
Par son point de fusion, le phényluréthanne permet d’identifier l’alcool.
En présence de HCl, les alcools primaires acétalisent les aldéhydes :
Toutes ces réactions sont moins faciles pour les alcools secondaires et surtout pour les alcools tertiaires.
La plus caractéristique des réactions correspondant à la coupure R—OH est l’éthérification halohydrique :
Elle est très rapide pour les alcools tertiaires, et si l’hydracide est lourd (HI).
Pour les alcools primaires, il vaut mieux utiliser PCl5, qui coupe à la fois la liaison R—OH et la liaison RO—H :
Avec les alcools tertiaires, un chlorure d’acide conduit à l’éther chlorhydrique :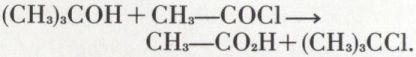
Sur alumine vers 350 °C, les alcools primaires engendrent avec NH3 des amines :
Les alcools primaires et secondaires peuvent être déshydratés en éthers-oxydes, soit par passage sur alumine vers 250 °C, soit par l’acide sulfurique vers 140 °C :
La déshydratation en alcène, par exemple,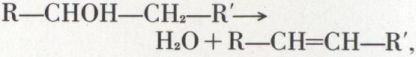
se fait catalytiquement sur alumine entre 350-450 °C ou par l’acide sulfurique vers 160 °C. Toutefois, les alcools tertiaires sont déshydratés par ébullition avec un acide fort dilué.
Les alcools non tertiaires sont partiellement déshydrogénés par passage sur nickel vers 180 °C :
La même déshydrogénation résulte d’une oxydation ménagée (KMnO4, CrO3 sans excès).
Toutefois, dans le cas des alcools primaires, l’oxydation va facilement plus loin :
Il en sera de même, si l’oxydant est en excès, dans le cas des alcools secondaires, la plupart des cétones R—CO—R′ étant oxydables en deux ou plusieurs acides, par dégradation.
Les alcools tertiaires sont peu oxydables et, si l’on insiste, ils sont dégradés en plusieurs acides moins riches en carbone.
Les dérivés de la fonction alcool sont du type R—OA, A étant un radical variable.
Les alcoolates RONa sont des agents de synthèse très actifs, transformant, en particulier, les éthers halohydriques non tertiaires en éthers-oxydes :
Avec les éthers halohydriques tertiaires, ils provoquent au contraire une déshydrohalogénation éthylénique :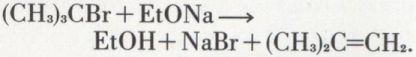
Les éthers d’oxacides minéraux forts se comportent, la plupart du temps, comme les éthers halohydriques :
Ceux des acides minéraux faibles (borates, nitrites) sont très facilement hydrolysés :
Les éthers-oxydes R—O—R ou R—O—R′, dont nous venons de voir les principales préparations, se forment également dans une réaction synthétique, l’action d’un organomagnésien sur l’éther chlorométhylique :
Les premiers termes :
sont des gaz ; le plus important, l’oxyde d’éthyle ou éther ordinaire C2H5—O—C2H5, bout à 34 °C. Les autres éthers-oxydes sont des liquides d’odeur forte, bons solvants des composés liposolubles. Seuls les premiers termes présentent avec l’eau une miscibilité notable, mais partielle.
Les éthers-oxydes sont chimiquement très stables ; on observe cependant, en présence de lumière, des substitutions sous l’action du chlore.
Ils ne sont pas hydrolysés en milieu neutre, alcalin ou faiblement acide.
Le retour aux alcools générateurs exige l’emploi d’acides forts concentrés ; une première coupure conduit à l’alcool le plus long et à l’éther minéral de l’alcool le plus court :
HI réalise cette coupure à froid, HBr vers 100 °C, HCl à 150 °C (à l’autoclave), H2SO4 vers 60 °C.
Les éthers-oxydes sont moins oxydables que les alcools ; en insistant, on arrive aux produits normaux de l’oxydation des alcools générateurs.
Les éthers-oxydes forment, avec certains acides, des sels cristallisés dits « sels d’oxonium » :
C’est le cas, en particulier pour l’acide ferrocyanhydrique (réaction caractéristique des éthers-oxydes).
Les éthers-oxydes complexent les métaux de transition, ce qui explique le rôle de l’oxyde d’éthyle dans la formation des organomagnésiens existant sans doute sous la forme complexée
C. P.
Alcool éthylique ou éthanol
L’alcool éthylique, ou éthanol, est de loin l’alcool le plus important, tant sur le plan pratique que sur le plan économique. On le désigne dans le langage courant par le mot « alcool » sans qualificatif.
Généralités
La composition et la formule chimique de l’alcool furent établies par Saussure, Dumas* et Boullay vers 1827, et Berthelot* en réalisa la synthèse en 1854. Il est fabriqué souvent de façon artisanale (eaux-de-vie), mais aussi, surtout depuis le milieu du xixe s., de façon industrielle, à partir de matières premières très diverses. C’est un des constituants essentiels des boissons fermentées, des eaux-de-vie et, en général, des spiritueux alimentaires. Il est également utilisé dans nombre d’industries comme matière première ou réactif de fabrication.




