combinaisons (lois des) (suite)
Loi de conservation des éléments
Elle prolonge et précise celle de conservation de la masse : c’est non seulement la masse totale, mais encore celle de chacun des éléments que renferme le système qui demeure constante au cours des réactions chimiques. C’est une loi de non-transmutation chimique des éléments ; on sait que cette transmutation est réalisable, mais seulement dans les réactions nucléaires, telle la radioactivité.
Loi des proportions définies
J. L. Proust, 1801. Les proportions suivant lesquelles des éléments se combinent pour former des composés ne sont pas susceptibles de variations continues. Par exemple, hydrogène et oxygène peuvent, en s’unissant, donner de l’eau ou du peroxyde d’hydrogène : le rapport de l’oxygène à l’hydrogène est, dans le second, le double de ce qu’il est dans le premier ; il y a donc une nette discontinuité dans les proportions. Cette loi, affirmant l’invariabilité de composition des espèces chimiques, oppose celles-ci aux mélanges, dont on peut faire varier la composition de façon continue. Elle fut l’occasion d’une vive controverse entre son auteur et Berthollet* ; ce dernier, qui se faisait de la combinaison une idée différente de celle de Proust, n’admettait pas la loi des proportions définies comme un énoncé général. Ce fut Proust qui triompha ; cependant, on connaît actuellement un certain nombre de composés solides — tels des oxydes ou des sulfures métalliques (oxyde et sulfure ferreux, oxyde de titane.) — qui, malgré une structure cristalline bien définie, peuvent, d’un échantillon à l’autre, présenter d’importantes variations dans la composition élémentaire ; on les appelle, tout naturellement, des berthollides. Ces variations semblent dues à des lacunes dans le réseau cristallin, accompagnées d’un accroissement de la valence électrochimique d’un certain nombre d’atomes métalliques.
Loi des proportions multiples
J. Dalton*, 1803. Lorsque deux corps simples peuvent, en s’unissant, former plusieurs composés, les masses de l’un d’eux qui, dans la formation de ces divers composés, s’unissent à la même masse de l’autre sont entre elles dans les rapports de nombres entiers généralement petits (1, 2, 3 ...). L’exemple des composés oxygénés de l’azote est classique : l’analyse révèle qu’à 14 g d’azote sont unis 8 g d’oxygène dans l’hémioxyde, 16 g dans le monoxyde, 24 g dans le sesquioxyde, 32 g dans le dioxyde, 40 g dans l’hémipentoxyde ; les rapports entre les masses d’oxygène, prises deux à deux, sont simples au sens indiqué plus haut.
Remarquons ici qu’à l’aide de la notion d’atomes les lois précédentes s’interprètent aisément si l’on admet, comme le fit Dalton, le principe d’indestructibilité des atomes dans les réactions chimiques ainsi qu’un principe de simplicité dans la formation des composés ; nous dirons aujourd’hui, par exemple, qu’une molécule est généralement formée d’un petit nombre (1, 2, 3 ...) d’atomes semblables ou différents ; généralement, mais non nécessairement, car nous savons qu’il existe, notamment en chimie organique, des molécules formées d’un grand nombre d’atomes.
Loi des nombres proportionnels
Elle est attribuée à J. B. Richter. Le rapport des masses suivant lesquelles deux éléments s’unissent à la même masse d’un même troisième élément est dans un rapport simple (au sens indiqué plus haut) avec le rapport des masses suivant lesquelles ces deux éléments s’unissent directement entre eux. Ainsi, l’analyse révèle qu’à 16 g d’oxygène s’unissent ou bien 71 g de chlore pour former l’hémioxyde de chlore ou bien 12,4 g de phosphore pour former l’anhydride phosphorique, alors que, dans la formation d’un composé de chlore et de phosphore, soit par exemple le pentachlorure de phosphore, à 177,5 g de chlore sont unis 31 g de phosphore. On forme le rapport des deux rapports : 71/12,4 et 177,5/31, et l’on trouve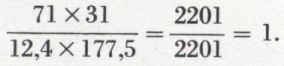
Cette loi est importante, car elle permet l’établissement d’une notation* chimique cohérente et simple : si, prenant comme élément de référence l’oxygène par exemple (choix heureux puisqu’on connaît des combinaisons de cet élément avec presque tous les autres), on fait pour tous les éléments un travail analogue à celui de l’exemple précédent, on détermine ainsi pour chaque élément un ou plusieurs nombres (car l’oxygène peut donner une ou plusieurs combinaisons), tels que 71 pour le chlore, 12,4 pour le phosphore, 16 pour le soufre, 12 pour le carbone..., qui sont proportionnels — les rapports de proportionnalité étant simples — aux masses de ces éléments qui se combinent entre elles ; ce sont des nombres proportionnels de ces éléments.
Jeremias Benjamin Richter
Chimiste allemand (Hirschberg, Silésie, 1762 - Berlin 1807). Il montra qu’il existait des rapports déterminés de masses entre les constituants des sels et fournit les poids équivalents des acides et des bases. De cette observation dérive la loi des nombres proportionnels.
Lois volumétriques
Gay-Lussac*, 1808. Tous les volumes gazeux étant mesurés dans les mêmes conditions de température et de pression :
1o lorsque deux corps gazeux s’unissent, les volumes réagissants sont entre eux dans un rapport simple ;
2o si le composé formé est lui aussi gazeux, son volume est dans un rapport simple avec ceux des gaz réagissants.
Ainsi 2 volumes d’hydrogène s’unissent à 1 volume d’oxygène pour former de l’eau ; 3 volumes d’hydrogène s’unissent à 1 volume d’azote pour former 2 volumes de gaz ammoniac.
Les lois de Gay-Lussac ne sont qu’approchées, car les lois physiques auxquelles obéissent la compressibilité et la dilatation des gaz ne sont pas simples dans les conditions habituelles de température et de pression ; de façon plus précise, les lois physiques des gaz ne deviennent simples que sous des pressions très faibles ; avec elles, les lois volumétriques des combinaisons sont des lois limites.
Les lois volumétriques ont paru d’abord en contradiction avec l’hypothèse de Dalton de l’insécabilité des atomes. C’est Avogadro* qui, introduisant pour le corps simple la notion de molécule, habituellement formée de plusieurs atomes, et énonçant sa célèbre hypothèse — dans les mêmes conditions de température et de pression, des volumes égaux de tous les gaz renferment le même nombre de molécules —, permit une interprétation cohérente des lois de Gay-Lussac.
R. D.




