thermodynamique (suite)
On généralise en thermodynamique la notion d’énergie mécanique d’un système en considérant celui-ci comme un réservoir d’énergie, alimenté, en raison de l’équivalence, indifféremment par l’absorption de travail ou par celle de chaleur, et plus généralement par l’absorption d’autres variétés d’énergie. Cette énergie indifférenciée, associée au système dans chacun de ses états, est ce qu’on nomme l’énergie interne U ; c’est pour le système considéré une fonction d’état, dont les variations d’un état à un autre sont représentées par la somme W + Q. On écrit :
pour une transformation finie,
dU = dW + dQ
pour une transformation infiniment petite. U étant fonction d’état, dU est différentielle totale, contrairement à dW ou dQ, dont la valeur dépend des modalités de la transformation. On verra plus loin comment l’affirmation de dU différentielle totale constitue un moyen mathématique efficace d’utilisation du premier principe.
Ce qui précède entraîne pour un système isolé le principe de la conservation de son énergie, affirmation qui constitue une extension à l’énergie interne du principe de la conservation de l’énergie mécanique. Il est également évident qu’on ne peut produire du travail sans consommation d’une quantité équivalente d’énergie ; il revient au même d’affirmer qu’il serait absurde de chercher à réaliser un « moteur perpétuel » qui créerait indéfiniment du travail « à partir de rien ».
Principe de Carnot
Historiquement, sa connaissance a précédé celle du principe de l’équivalence : c’est en 1824 que Sadi Carnot affirma que la production de force motrice est liée, dans les machines thermiques, à l’existence d’une différence de température « des corps entre lesquels se fait le transport de calorique ». Vers 1850, W. Thomson énonça qu’il est impossible d’obtenir du travail d’une machine cyclique si l’on ne dispose que d’une source de chaleur ; et Clausius, vers la même époque, affirma qu’on ne peut transporter de la chaleur d’un corps froid sur un corps chaud sans faire intervenir un phénomène auxiliaire, par exemple la transformation de travail en chaleur. On peut montrer que ces énoncés sont équivalents et énoncer ainsi le deuxième principe : un système en évolution cyclique ne peut fournir de travail que si, à chaque cycle, il entre en contact avec deux (ou moins) sources de chaleur à des températures différentes et si, empruntant de la chaleur à la source chaude, il en cède à la source froide.
Ainsi, le deuxième principe affirme l’impossibilité de produire du travail à l’aide d’un moteur dont le cycle serait monotherme : bien que cela ne soit pas en contradiction avec le premier principe, il serait absurde de chercher à réaliser un moteur cyclique qui, par exemple, prélevant de la chaleur à l’eau de la mer, dont il abaisserait ainsi la température, transformerait cette chaleur en travail et ferait ainsi avancer le navire « en laissant simplement derrière lui un sillage de glace » (Charles Fabry, Thermodynamique).
Dans le cas d’un cycle ditherme, deux sources de chaleur sont en jeu : le système reçoit la quantité de chaleur Q1 de la source chaude, dont la température est t1, et cède à la source froide, de température t2, la quantité de chaleur q2 (il en reçoit Q2 = – q2) ; c’est donc la différence Q1 – q2 (= Q1 + Q2) qui est transformée en travail à chaque cycle.
Dans le cas où les transformations sont réversibles, un cycle ditherme est nécessairement formé de deux transformations isothermes au contact des sources, encadrant deux transformations adiabatiques réversibles lors de l’évolution du système d’une source à l’autre. Un cycle ditherme réversible est dit cycle de Carnot. Conventionnellement, on définit le rendement d’une machine thermique par le rapport  du travail
du travail  fourni à chaque cycle à la quantité de chaleur Q1 reçue de la source chaude. Le théorème de Carnot indique que le rendement est maximal dans le cas où les transformations sont réversibles et qu’alors il ne dépend pas de la nature du système qui évolue entre les sources, mais uniquement des températures de celles-ci :
fourni à chaque cycle à la quantité de chaleur Q1 reçue de la source chaude. Le théorème de Carnot indique que le rendement est maximal dans le cas où les transformations sont réversibles et qu’alors il ne dépend pas de la nature du système qui évolue entre les sources, mais uniquement des températures de celles-ci :
avec |Q2|/Q1 = f (t1, t2). On montre que f (t1, t2) est de la forme 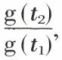 la forme de la fonction g dépendant de l’échelle dans laquelle sont repérées les températures t. W. Thomson suggéra de définir une échelle T, universelle et mesurable, dite thermodynamique des températures, par la relation g (t) = T, et, par suite, |Q2|/Q1 = T2/T1, relation qui définit le rapport mesurable des deux températures thermodynamiques, T2 de la source froide et T1 de la source chaude. Il résulte en particulier de cette définition que le rendement du moteur réversible (rendement de Carnot) est ρm = 1 – T2/T1, et ce rendement* est d’autant plus élevé que le rapport T2/T1 des températures des sources est plus faible.
la forme de la fonction g dépendant de l’échelle dans laquelle sont repérées les températures t. W. Thomson suggéra de définir une échelle T, universelle et mesurable, dite thermodynamique des températures, par la relation g (t) = T, et, par suite, |Q2|/Q1 = T2/T1, relation qui définit le rapport mesurable des deux températures thermodynamiques, T2 de la source froide et T1 de la source chaude. Il résulte en particulier de cette définition que le rendement du moteur réversible (rendement de Carnot) est ρm = 1 – T2/T1, et ce rendement* est d’autant plus élevé que le rapport T2/T1 des températures des sources est plus faible.
Le principe de Carnot, en affirmant que la transformation de chaleur en travail doit s’accompagner d’une chute de température, fait de l’énergie calorifique, du point de vue de sa conversion en d’autres variétés, une énergie comme les autres : la conversion de la chaleur nécessite une chute de température, comme celle de l’énergie potentielle de pesanteur nécessite une baisse de niveau, celle de l’énergie cinétique une diminution de vitesse, celle de l’énergie électrique une chute de potentiel, etc. L’analogie prend une forme mathématique précise à l’aide des extensités et des variables de tension ; de même qu’on écrit dW = h · g · dm pour exprimer l’accroissement de l’énergie potentielle de pesanteur de la masse dm passant de l’altitude zéro à l’altitude h ou dW = V · dq pour exprimer l’accroissement d’énergie électrique de la charge dq passant du potentiel zéro au potentiel V, etc., de même on écrira dQ = T · dS pour exprimer un accroissement d’énergie calorifique, définissant ainsi par dS = dQ/T et S = ∫ dQ/T l’extensité de la chaleur, grandeur à laquelle Clausius a donné (1865) le nom d’entropie*.




