sublimation
Passage direct de l’état solide à l’état vapeur. Le changement d’état inverse est dit « condensation directe de la vapeur en solide ».
Introduction
Abandonnés à l’air libre, certains solides — iode, naphtalène, camphre — s’évaporent assez rapidement dès la température ordinaire, plus vite si l’on chauffe (application à la purification de certains d’entre eux) ; il en est de même, mais de façon moins rapide, pour la glace aux températures inférieures à 0 °C ; par contre, les métaux ne se subliment pratiquement pas aux températures ordinaires.
La sublimation d’un corps pur cristallisé est, comme sa fusion ou comme la vaporisation du liquide, une transition de première espèce (v. corps pur) et obéit aux lois des équilibres univariants (1 constituant, 2 phases, v = 1) : la pression pS de l’équilibre cristal-vapeur, dite pression de sublimation, est fonction de la seule température ; il existe pour chaque corps pur, dans le repère T,p, une courbe de sublimation. Par application des lois du déplacement de l’équilibre, la pente de cette courbe est toujours positive, car, à T et p constants, la sublimation s’accompagne d’une augmentation de volume et d’une absorption de chaleur. Cette courbe est le lieu des points figuratifs de l’équilibre cristal-vapeur et sépare deux domaines du plan T,p, figuratifs des états stables monophasés cristal et vapeur (fig. 1). Elle n’est pas limitée vers les basses températures, pour lesquelles pS devient seulement très faible ; vers les hautes températures, elle est limitée au point triple (v. corps pur), où se rejoignent, disposées en étoile, les trois courbes d’équilibres diphasés du corps pur. Suivant que la pression du point triple est inférieure ou supérieure à la pression atmosphérique, le corps pur, chauffé sous cette dernière pression, fond avant de bouillir, c’est-à-dire existe à l’état liquide dans un certain domaine de températures (cas le plus fréquent), ou se sublime, le liquide n’étant stable que sous des pressions plus élevées (CO2, fig. 2). Seul l’hélium, qui n’a pas de point triple, n’a pas de courbe de sublimation.


Chaleur de sublimation
C’est, comme pour les autres changements d’état, la quantité de chaleur qu’il faut fournir à l’unité de masse du cristal pour le sublimer, à T et p constants. Elle est donnée par la formule de Clapeyron
LS = T(uV – uS) dpS/d′T,
uV et uS étant les volumes massiques de la vapeur et du solide ; c’est aussi la variation d’enthalpie massique qui accompagne la sublimation, et elle est liée à la variation d’entropie ΔS par LS = T . ΔS ; on voit donc que, comme pour les autres changements d’état, la quantité
ΔG = ΔH – T . ΔS
est nulle ; l’enthalpie libre massique G a la même valeur à l’équilibre pour le cristal et pour sa vapeur. Les mesures directes de chaleur de sublimation étant délicates et peu précises, c’est la formule de Clapeyron qui fournit le meilleur moyen d’obtenir LS ; rappelons enfin qu’au point triple la chaleur de sublimation d’un corps pur est égale à la somme des chaleurs de fusion et de vaporisation :
LS = LF + LV.
R. D
substitution
Tout automorphisme d’un ensemble fini.
Généralités
Une substitution opère dans un ensemble E fini dont les éléments peuvent donc être indexés par une partie finie de l’ensemble ℕ des entiers naturels. Le plus simple est d’identifier l’ensemble E à l’ensemble {1, 2, ..., n}, n ∈ ℕ. Une substitution est alors une bijection de l’ensemble {1, 2, ..., n} = E. Elle transforme tout élément de l’ensemble E en un élément de l’ensemble E, et deux éléments distincts ont deux images distinctes. On convient de représenter une substitution par deux lignes, la première indiquant l’ensemble E dans lequel on se place, les éléments étant rangés dans l’ordre naturel, la seconde indiquant les images obtenues par la substitution.
Exemple. n = 3, E = {1, 2, 3}, 
σ opère dans l’ensemble E de façon que :
σ (1) = 3 ; σ (2) = 1 ; σ (3) = 2.
Ainsi, une substitution est définie par sa seconde ligne, c’est-à-dire par une permutation de l’ensemble E. Il y a autant de substitutions de l’ensemble E que de permutations des éléments de l’ensemble E, donc n !
Groupe symétrique Sn
On peut munir l’ensemble des substitutions opérant dans un ensemble E de cardinal n d’une opération interne, qui est la composition des applications, notée ◦ et qui est associative. Ainsi, σ = β ◦ α est une substitution définie à partir des deux substitutions α et β opérant dans E = {1, 2, ..., n}, de façon que, si α (i) = j et β (j) = k, σ (i) = β [α (i)] = k, quand i décrit l’ensemble E.
Exemple. 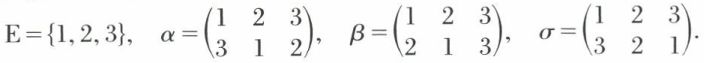
De plus, quel que soit n, il existe une substitution identique de l’ensemble E, celle qui laisse inchangé tout élément de cet ensemble. Enfin, étant donné la substitution σ opérant dans l’ensemble E, celle-ci est une bijection de l’ensemble E, et il existe une bijection réciproque, notée σ–1, telle que, si σ (i) = j, σ–1 (j) = i et σ ◦ σ–1 = σ–1 ◦ σ = IE, identité de E. L’ensemble des substitutions de l’ensemble E forme donc un groupe qu’on appelle le groupe symétrique, noté Sn et dont l’ordre est n! Cette structure fait l’intérêt de l’ensemble des substitutions opérant dans un ensemble de cardinal n.
Décomposition d’une substitution
On appelle cycle ou permutation circulaire toute substitution qui transforme, dans E = {1, 2, ..., n}, chaque élément en son suivant et n en 1. On note (1, 2, 3, ..., n – 1, n) ou simplement (1, 2, ..., n) au lieu de 
On appelle transposition tout cycle d’ordre deux tel que (2, 5), qui signifie 2 est transformé en 5 et 5 en 2.
• Toute substitution σ est le produit de cycles deux à deux permutables, opérant sur des ensembles formant une partition de E. L’ordre de σ est égal au p. p. m. c. des ordres des cycles composants.
example. Dans E = {1, 2, 3, 4, 5, 6, 7, 8, 9, 10},




