atome (suite)
Représentation des orbitales de l’atome d’hydrogène
Dans la théorie de Bohr, la représentation des orbites permises à l’électron ne présentait aucune difficulté, puisqu’il suffisait de tracer les lignes circulaires centrées sur le noyau, dont le rayon était donné par la théorie ; l’addition faite par Sommerfeld conduisait à ajouter aux courbes précédentes des ellipses dont un foyer est au centre du noyau de l’atome, ellipses en nombre d’ailleurs limité : zéro pour n = 1, une pour n = 2, etc. En mécanique ondulatoire, il n’en est plus de même : le principe d’incertitude enlève toute signification précise à la notion d’orbite, et l’équation de Schrödinger ne fournit que des orbitales, qui nous renseignent seulement sur la probabilité de trouver l’électron en un point de l’espace ; il devient dès lors beaucoup plus difficile de donner une représentation imagée de la façon dont se comporte l’électron. Dans l’équation de Schrödinger, la séparation des variables r, θ et φ ayant fourni des orbitales d’équation
ψ = R(r).Θ(θ).Φ(φ),
on peut d’abord, pour chacune d’elles, représenter, en fonction de la distance r au noyau, soit la fonction R(r) elle-même, soit la fonction δ = r2.R2(r), de distribution radiale de probabilité ; cette dernière courbe, déjà tracée ici pour l’orbitale 1s, montre, avec des maximums dont le nombre et l’importance varie avec n, que l’électron reste en moyenne d’autant plus éloigné du noyau que le nombre quantique n est plus grand. On peut ensuite représenter la partie angulaire de l’orbitale, ou encore son carré, qui est pour l’orbitale considérée la fonction de distribution angulaire de probabilité. On porte à partir de l’origine, dans la direction faisant l’angle θ avec l’axe de symétrie, la valeur correspondante de cette fonction ; celle-ci étant constante pour les orbitales s, qui ne dépendent que de r, la courbe méridienne est alors un cercle centré sur l’origine ; mais, pour une orbitale 2 p, la courbe méridienne est formée de deux lobes symétriques par rapport à l’origine (fig. 4), ce qui montre que la probabilité de présence de l’électron dépend ici fortement, pour r donné, de la direction. Il est important de noter, cependant, que la direction de plus grande probabilité reste parfaitement indéterminée dans l’atome tant que celui-ci, isolé, n’est soumis à aucune action extérieure ; par contre, dès qu’une telle action se manifeste, approche d’un autre atome ou excitation par un champ magnétique par exemple, cette action détermine l’orientation des orbitales ; cette remarque joue un rôle important dans l’étude des liaisons chimiques.
On peut enfin tracer dans un plan méridien les courbes |ψ|2 = constante, cotées par exemple de 1 à 0, c’est-à-dire par rapport à la valeur maximale de |ψ|2 ; dans le cas des orbitales s, qui ne dépendent que de r, on obtient des circonférences centrées sur le noyau ; pour les autres orbitales, la forme est plus compliquée, comme le montre la figure relative à une orbitale 2 p. En chaque point d’une de ces courbes, la densité de probabilité est la même, et elle décroît d’une courbe à la suivante qui l’entoure ; on peut, dès lors, rendre la représentation plus sensible en ombrant en chaque point, proportionnellement à la valeur de |ψ|2 en ce point, c’est-à-dire en réalisant un nuage d’autant plus dense que la probabilité d’y trouver l’électron est plus forte ; c’est le nuage électronique, qui se dilue et devient invisible dans les régions où |ψ|2 est presque nul, en particulier à grande distance du noyau.
Structure électronique des atomes autres que l’hydrogène
Gravitant autour d’un noyau de charge positive + Ze, chacun de ces atomes comporte Z électrons ; Z, dit « nombre » ou « numéro atomique » de l’atome, égal à 1 pour l’hydrogène, croît par valeurs entières successives depuis Z = 2 pour l’hélium jusqu’à Z = 92 pour l’uranium, du moins en ce qui concerne les atomes naturels ; au-delà, des atomes ont été artificiellement créés, dont le nombre atomique va de Z = 93 pour le neptunium jusqu’à Z = 103 pour le lawrencium, et la liste n’est certainement pas close. Dans chaque atome, les Z électrons, qui, accompagnant le noyau, assurent la neutralité électrique de l’atome, ne constituent pas une foule désordonnée : chaque électron occupe sinon une place, du moins un « état » déterminé, et l’atome, dans son ensemble, possède de ce fait une certaine structure ; le problème est celui de sa détermination pour l’atome dans son état fondamental, c’est-à-dire lorsqu’il n’est soumis à aucune sollicitation extérieure ; et c’est aussi celui des variations éprouvées par cette structure fondamentale sous l’effet d’actions extérieures, telles que choc avec un autre atome ou action d’un rayonnement, actions qui placent l’atome, momentanément, dans un état excité.
Comme pour l’atome d’hydrogène, c’est l’équation de Schrödinger qui doit, en principe, fournir la solution, sous la forme de fonctions d’onde ψ, dont chacune est maintenant, de même que Δψ, fonction des coordonnées des Z électrons ; E est l’énergie totale et U la somme des énergies potentielles des électrons, somme qui comprend maintenant des termes provenant des actions mutuelles des électrons pris deux à deux. Cela suffit pour montrer que l’équation se complique dès les plus petites valeurs de Z > 1, à tel point qu’il n’est plus possible d’en déterminer les solutions exactes ; il est donc nécessaire, avant de résoudre, de consentir à certaines approximations.
Approximation de l’atome hydrogénoïde
On appelle ion hydrogénoïde un ion formé d’un noyau de charge + Ze, autour duquel gravite un seul électron ; il en est ainsi de l’atome d’hélium une fois ionisé He+, de l’atome de lithium deux fois ionisé Li2+, etc. La détermination des orbitales de ces ions hydrogénoïdes se fait au moyen d’une équation de Schrödinger en tout point semblable à celle qui définit les orbitales de l’atome d’hydrogène, à cela près que, la charge du noyau étant + Ze, l’énergie potentielle de l’électron est maintenant
U = – Ze2/4πε0r ;
on retrouve donc le même nombre et la même distribution d’orbitales que dans l’atome d’hydrogène ; l’énergie de l’électron ayant ici pour expression
L’étude expérimentale, en particulier celle des spectres d’émission de ces ions, apporte à ce qui précède une confirmation précise. On appelle approximation de l’atome hydrogénoïde celle qui consiste, dans le cas de l’atome d’hélium par exemple, à négliger les actions mutuelles de ses deux électrons. Dans ces conditions, les fonctions d’onde des électrons sont celles des ions hydrogénoïdes ; il en est de même pour l’expression de l’énergie E dans les différents niveaux. Si l’on admet que, dans l’état fondamental de l’atome He, les deux électrons sont dans le niveau 1 s, l’expression précédente de E fournit pour l’énergie d’ionisation la valeur 4.13,6 = 54,4 eV ; mais si l’on admettait dans l’état fondamental un électron 1 s et un électron 2 s, l’énergie d’ionisation serait celle qui correspondrait au niveau 2 s, c’est-à-dire 13,6 eV ; l’expérience fournit une valeur intermédiaire : 24,6 eV ; on est donc fondé à placer les deux électrons au niveau 1 s, compte tenu de ce que la répulsion électronique, que l’on a négligée, ne peut que diminuer l’énergie d’ionisation. Enfin, l’étude expérimentale des propriétés magnétiques de l’atome He montre que le moment de spin résultant est nul, donc que les deux électrons ont des spins opposés : 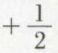 et
et  De même, l’application de l’approximation hydrogénoïde à l’atome Li, qui renferme trois électrons, ainsi que les résultats expérimentaux le concernant conduisent à admettre qu’il comporte dans l’état fondamental deux électrons 1 s de spins opposés, le troisième étant sur le niveau 2 s.
De même, l’application de l’approximation hydrogénoïde à l’atome Li, qui renferme trois électrons, ainsi que les résultats expérimentaux le concernant conduisent à admettre qu’il comporte dans l’état fondamental deux électrons 1 s de spins opposés, le troisième étant sur le niveau 2 s.




