Sei Shōnagon (suite)
Le reste est fait de récits de choses vues, de courtes scènes prises sur le vif, au jour le jour, de descriptions impressionnistes des gens et des choses ; petites comédies dont les personnages sont l’empereur, l’impératrice, les ministres, les courtisans et les dames. Bien peu pouvaient se flatter de trouver grâce devant cette impitoyable portraitiste qui ne renonce à la caricature que lorsqu’elle parle des souverains ou d’elle-même. Car, et c’est là sa seule faiblesse, elle ne peut se défendre d’une certaine complaisance envers son propre personnage : versée dans les lettres chinoises et japonaises, douée à l’en croire d’un redoutable esprit d’à-propos, elle prétend ne jamais rester en retard d’une épigramme, ripostant avec la même facilité à une pointe de l’empereur ou au madrigal d’un fat. D’un caractère dominateur et impulsif, elle fait volontiers étalage d’érudition, tout en manifestant une certaine condescendance pour les femmes qui se piquent d’écrire ; peu émotive, il lui arrive cependant de s’attendrir à la vue d’un enfant ou sur le sort d’un chien ; toute sa sympathie va à l’impératrice, qu’elle admire et dont elle respecte les vertus et les malheurs. Elle est moins sentimentale que Murasaki ; un sens très aigu du ridicule l’éloigné de toute préciosité de pensée ou d’expression.
Les imitateurs du Makura no zōshi seront aussi nombreux que ceux du Genji-monogatari, et le zuihitsu deviendra bientôt, et restera jusqu’à nos jours, l’un des genres les plus prisés de la littérature japonaise. Le moine Kenkō (Yoshida Kaneyoshi, 1283-1350) s’en inspire, et le dit explicitement, dans son Tsurezure-gusa (Notes au fil du désœuvrement).
R. S.





 et
et 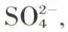 d’où, avec NaOH, les sels
d’où, avec NaOH, les sels  dit hydrogénosulfate de sodium, et
dit hydrogénosulfate de sodium, et  dit sulfate di-sodique. Il correspond de même à l’acide orthophosphorique H3PO4 trois sels de sodium : dihydrogénophosphate monosodique NaH2PO4, monohydrogénophosphate disodique Na2HPO4, phosphate trisodique Na3PO4. On emploie quelquefois encore les termes de sel acide pour désigner les hydrogénosels et de sel neutre pour désigner ceux qui ne contiennent pas d’« hydrogène acide » ; cette désignation prête à confusion, en particulier parce que, par suite de l’
dit sulfate di-sodique. Il correspond de même à l’acide orthophosphorique H3PO4 trois sels de sodium : dihydrogénophosphate monosodique NaH2PO4, monohydrogénophosphate disodique Na2HPO4, phosphate trisodique Na3PO4. On emploie quelquefois encore les termes de sel acide pour désigner les hydrogénosels et de sel neutre pour désigner ceux qui ne contiennent pas d’« hydrogène acide » ; cette désignation prête à confusion, en particulier parce que, par suite de l’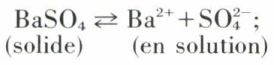
 Ps, fonction de la température, est le produit de solubilité du sel dans l’eau ; pour BaSO4 à 20 °C, Ps = 10–10 mole2.]–2.
Ps, fonction de la température, est le produit de solubilité du sel dans l’eau ; pour BaSO4 à 20 °C, Ps = 10–10 mole2.]–2. ou
ou 