pile électrochimique (suite)
Théorie des piles électriques
Un métal M plongé dans une solution contenant ses ions Mn+ voit passer les ions du réseau métallique en solution, le métal se chargeant négativement par excès d’électrons et attirant les ions positifs du voisinage. On atteint un équilibre entre métal et ions et il apparaît une différence de potentiel EM caractéristique de ce métal et appelée tension absolue d’électrode. Sa valeur, établie par W. Nernst* vers 1890, est donnée par la formule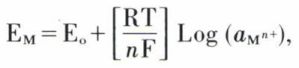
dans laquelle E0 est une constante appelée tension normale du métal, R la constante des gaz parfaits, T la température absolue, F le faraday et  l’activité des ions Mn+ dans la solution. Une pile constituée par l’association de deux électrodes dissemblables dans un électrolyte présente une force électromotrice égale, en circuit ouvert, à la différence de potentiel existant entre chaque interphase électrode-électrolyte, d’où l’intérêt d’utiliser des constituants présentant des tensions normales de valeur opposée les plus élevées possibles.
l’activité des ions Mn+ dans la solution. Une pile constituée par l’association de deux électrodes dissemblables dans un électrolyte présente une force électromotrice égale, en circuit ouvert, à la différence de potentiel existant entre chaque interphase électrode-électrolyte, d’où l’intérêt d’utiliser des constituants présentant des tensions normales de valeur opposée les plus élevées possibles.
D’autre part, à la réaction chimique qui se produit dans la pile au cours de son fonctionnement correspond une variation d’enthalpie ΔG du système formé par l’ensemble des réactifs. En exprimant l’égalité des travaux électriques et chimiques nFE = – ΔG et en combinant cette équation avec la relation de Gibbs-Helmholtz
on obtient
formule qui montre qu’à la force électromotrice d’origine chimique s’ajoute une force d’origine thermique. Le terme 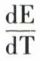 est le coefficient de température positif ou négatif de la pile. Si par exemple celle-ci emprunte de la chaleur au milieu extérieur pour que sa température reste constante, la force électromotrice de la pile est supérieure à celle qui est calculée d’après l’énergie chimique libérée.
est le coefficient de température positif ou négatif de la pile. Si par exemple celle-ci emprunte de la chaleur au milieu extérieur pour que sa température reste constante, la force électromotrice de la pile est supérieure à celle qui est calculée d’après l’énergie chimique libérée.
On peut donc considérer une pile comme un générateur de courant dont le fonctionnement est assuré par des réactions d’oxydoréduction. C’est ainsi que dans la pile Daniell, dont les deux électrodes sont constituées par les systèmes Zn/ZnSO4 et CuSO4/Cu, la production de courant, c’est-à-dire la circulation dans le circuit d’utilisation d’électrons qui se déplacent du zinc ou anode vers le cuivre ou cathode, s’accompagne à l’intérieur de la pile d’un transport de ces électrons par l’intermédiaire d’ions, le zinc recevant deux électrons provenant de la transformation d’un atome de Zn en ion Zn2+, qui passe en solution, tandis que l’électrode de cuivre fournit à un ion Cu2+ deux électrons et le transforme en un atome de cuivre qui se dépose sur l’électrode correspondante :
Zn → Zn2+ + 2 e– et Cu2+ + 2 e– → Cu.
Mais, au cours du fonctionnement de certaines piles et contrairement au cas de la pile Daniell, des modifications peuvent se produire sur les électrodes. On dit que la pile est polarisable. C’est ainsi que, dans la pile Volta, de l’hydrogène se dégage sur le cuivre, adhère à sa surface et donne naissance à une forme contre-électromotrice. La f. é. m. de la pile diminue jusqu’à devenir pratiquement nulle ; on combat ce phénomène en éliminant de façon continue les produits de réaction responsables de la polarisation par l’emploi de dépolarisants. On peut donc grouper les piles en deux catégories, les piles impolarisables et les piles à dépolarisation. Les premières ont peu d’applications pratiques, et l’historique des piles industrielles est constitué par l’ensemble des moyens qui ont été imaginés pour combattre cette polarisation.
Piles à dépolarisation
Suivant l’état physique du dépolarisant, on distingue les piles à dépolarisant gazeux, liquide ou solide.
Dépolarisation par les gaz
C’est Charles Féry (1865-1935) qui réalisa en 1916 une des premières piles pratiques de ce type, formée d’une électrode en zinc et d’une autre en carbone poreux, l’électrolyte étant constitué par une solution de soude, puis de chlorure d’ammonium. Au cours du fonctionnement, il se forme du chlorure de zinc autour de l’anode, les ions H+ libérés de l’électrolyte se déchargeant sur l’électrode de carbone riche en oxygène adsorbé et apporté par l’air.
Dépolarisants solides
C’est le type le plus courant des piles industrielles.
— La pile sèche Leclanché (1868) est constituée d’une électrode en zinc et d’une en carbone entourée d’un mélange dépolarisant à base de bioxyde de manganèse. L’électrolyte est formé d’une pâte gélatineuse d’amidon imprégné d’électrolyte contenant du chlorure d’ammonium et du chlorure de zinc, et les réactions suivantes se produisent aux électrodes :
Zn + 2 OH– – 2 e– → Zn(OH)2
et
2 MnO2 + 2 H+ + 2e– → Mn2O3.H2O.
Cette pile a subi de nombreuses modifications : production de courant de plus forte intensité par réduction de l’épaisseur de la couche d’électrolyte, fonctionnement aux basses températures par modification de l’électrolyte, remplacement de l’électrolyte classique au chlorure d’ammonium par de la potasse caustique saturée de zincate de potassium.
— La pile Lalande et Chaperon (1881) a été améliorée par T. Edison* (1908) ; c’est une pile à dépolarisant à l’oxyde de cuivre et à électrolyte constitué de soude caustique.
— La pile de Ruben (1947) est constituée d’une anode en zinc, d’un dépolarisant d’oxyde mercurique, d’un électrolyte formé par une solution de potasse caustique saturée de zincate de potassium.
— L’élément au pentoxyde de vanadium est plus utilisé comme source de potentiel que comme source de courant.
— Les éléments au plomb dérivés de l’accumulateur contiennent PbO2 comme dépolarisant, l’électrolyte étant constitué par une solution d’acide perchlorique, fluoborique ou fluosilicique. Au cours de la décharge, il se forme aux deux électrodes un sel de plomb soluble, ce qui permet d’utiliser la totalité des constituants, anode et dépolarisant, jusqu’à leur épuisement. On peut également remplacer le plomb par du zinc ou du cadmium.
Piles amorçables (ou à action différée)
Une pile n’a pas une durée de conservation indéfinie ; on pallie cet inconvénient avec des piles amorçables, ou piles réserves, dont la mise en service s’effectue par introduction d’un électrolyte acide, d’un gaz ou par activation par la chaleur.




