pile à combustible (suite)
Piles secondaires
On classe ces piles d’après la nature du procédé de régénération adopté :
— piles à régénération par courant électrique ;
— piles à régénération thermique, par exemple par décomposition à chaud du produit de la combustion ;
— piles à régénération par l’énergie lumineuse ou nucléaire.
On groupe dans la catégorie des piles secondaires les piles indirectes, dans lesquelles on ne brûle pas directement le combustible par l’oxydant ; on utilise des réactions chimiques intermédiaires permettant de convertir l’énergie de combustion en énergie électrique : un milieu intermédiaire (solution oxydoréductrice) est réduit à l’anode et régénéré à part par l’oxydant. De même, une autre solution est oxydée à la cathode et régénérée à part par le combustible.
Description de quelques types de piles à combustible
Plusieurs piles industrielles ont été réalisées.
• La pile Bacon (fig. 3) est à électrodes dites « à double porosité », constituées d’une première couche de nickel poreux ayant des pores de 30 μ, placée du côté des chambres contenant le combustible (hydrogène) ou le comburant (oxygène), et d’une seconde couche, à pores plus réduits de 16 μ, placée du côté de l’électrolyte. Ce dernier est une solution de potasse caustique. La pile fonctionne à une température de 200 °C sous une pression de 28 bars.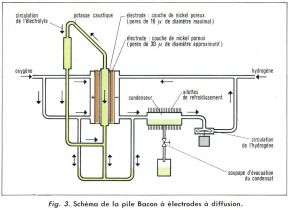
• La pile Alsthom utilise de la potasse caustique comme électrolyte, de l’hydrazine comme combustible et de l’eau oxygénée comme comburant. Il n’est plus nécessaire d’amener ces produits au travers d’électrodes poreuses ; par contre, pour que les réactifs ne réagissent pas directement, il faut séparer en deux l’électrolyte par une cloison semi-perméable. On peut avec cette pile consommer aussi des combustibles ou comburants gazeux grâce à l’emploi d’une électrode gaufrée à émulsion, sur laquelle on envoie l’électrolyte chargé de bulles de combustible ou de comburant. On pense appliquer ce principe à la réalisation de piles à hydrazine ou à méthanol et air.
• La pile indirecte Redox utilise des électrodes en charbon poreux immergées dans des solutions oxydoréductrices utilisant divers ions (fig. 4). À la décharge, l’oxydation de Sn+2 qui se produit à l’électrode négative transforme cet ion en Sn+4, tandis que la réduction à l’électrode positive transforme le brome moléculaire en brome ionisé. La régénération des solutions fournit alors de l’étain (II) et du brome qui sont recyclés, l’opération pouvant être effectuée par des réactifs qui jouent le véritable rôle de combustible et de comburant.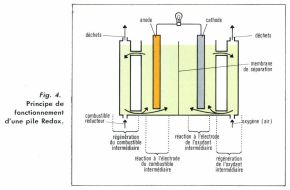
• La pile de la General Dynamics Co. est une pile à anode de zinc, le comburant étant l’oxygène de l’air. Cette pile a été conçue afin d’équiper une automobile ; elle permet d’atteindre une énergie massique de plus de 150 Wh/kg contre 20 à 30 pour les batteries au plomb classiques. L’oxyde de zinc formé pendant la décharge est entraîné par une solution de potasse, stocké dans un réservoir et réintroduit dans l’élément au moment de la recharge de la pile.
Domaines d’emploi des piles à combustible
C’est la pile à hydrogène et à oxygène ou à air qui semble la plus proche d’une exploitation industrielle ; l’hydrogène est fourni par des bouteilles de gaz comprimé. On envisage aussi l’emploi comme combustibles d’hydrocarbures, de gaz naturel, d’huiles ou de charbon. Le tableau suivant résume les caractéristiques des piles industrielles actuellement envisagées. Au point de vue militaire, la pile à combustible présente d’importants avantages du fait de l’absence de bruit et de source de chaleur ; l’absence presque complète de pièces mobiles réduit au minimum les dépenses d’entretien.
Dans le secteur civil, la pile à combustible est intéressante pour la production d’énergie nécessaire aux besoins d’une automobile ou d’une locomotive électriques et à ceux d’une habitation isolée.
On envisage également la création de centrales électriques à condition qu’on puisse utiliser un combustible bon marché. Jusqu’à présent, on n’a pas trouvé la solution pratique de l’utilisation directe du charbon, ce combustible doit être gazéifié ou il faut utiliser des combustibles liquides ou gazeux.

G. G.
➙ Accumulateur électrique / Électrochimie / Oxydoréduction / Pile électrochimique.
C. J. Young, Fuel Cells (New York, 1960). / E. Justi et A. Winsell, Kalte Verbrennung (Wiesbaden, 1962). / W. Mitchell, Fuel Cells (New York, 1963). / Les Piles à combustible (Technip, 1965). / H. A. Liebhafsky et E. J. Cairns, Fuel Cells and Fuel Batteries (New York, 1968).




