oxydoréduction (suite)
Potentiel d’oxydoréduction d’un couple redox
Une pile d’oxydoréduction est formée de deux demi-piles réunies par une jonction KCl (v. électrochimie), chaque demi-pile étant constituée par la solution aqueuse d’un couple redox dans laquelle plonge un métal inattaquable (platine). À cette pile correspond une force électromotrice (f. é. m.) due à ce que, les deux couples redox n’étant pas de même force, une réaction chimique tend à s’effectuer, si par exemple ox1 est plus fort que ox2, dans le sens
ox1 + red2 → ox2 + red1,
c’est-à-dire que dans la demi-pile (1) tend à s’effectuer au contact de l’électrode la réaction ox1 + e– → red1, alors que dans la demi-pile (2) tend à s’effectuer la réaction red2 → ox2 + e– ; le couple redox (1) emprunte des électrons à l’électrode (1), qui se charge positivement, alors que le couple (2) cède des électrons à l’électrode (2), qui se charge négativement ; une différence de potentiel (d.d.p.) V1 – V2 > 0 est ainsi créée entre les deux électrodes. La valeur de la f. e. m. de la pile, d.d.p. V1 – V2 en circuit ouvert, se déduit d’un raisonnement thermodynamique : la réaction ox1 + red2 → ox2 + red1 s’effectuerait dans le sens de la flèche, ox1 étant supposé plus fort que ox2, si l’on mélangeait les solutions ; l’affinité chimique de cette réaction n’est donc pas nulle, elle vaut :
(v. équilibre chimique). On peut effectuer la même réaction dans la pile, mais de façon pratiquement réversible, en disposant dans le circuit extérieur un générateur de f. é. m. presque égale à celle de la pile et en opposition avec elle. Si l’on permet, à l’aide d’un courant infiniment petit, au degré d’avancement ξ de la réaction de croître de dξ l’enthalpie libre du système éprouve une diminution 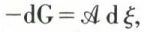 égale, puisque la transformation est réversible, au travail électrique fourni par la pile :
égale, puisque la transformation est réversible, au travail électrique fourni par la pile :  Si l’écriture de la réaction correspond au transfert de n électrons, la quantité totale d’électricité transportée pour Δξ = 1 est :
Si l’écriture de la réaction correspond au transfert de n électrons, la quantité totale d’électricité transportée pour Δξ = 1 est :
q = n.F ;
F étant le faraday ; d’où ici :
dq = n.Fdξ
et 
on en déduit :
On peut poser :  , f. é. m. normale de la pile (si toutes les activités sont égales à 1) ; la formule
, f. é. m. normale de la pile (si toutes les activités sont égales à 1) ; la formule
généralise la formule de Nernst (v. électrochimie). Si l’une des demi-piles est l’électrode normale à hydrogène (v. pH), dont on admet par convention qu’elle est équipotentielle, à la réaction d’écriture
correspond d’après la formule précédente la f. é. m.
relative au couple ox + ne– ⇄ red, comparé au couple  E0 est la tension normale redox de ce couple ; elle ne dépend pour celui-ci que de la température, la pression étant de 1 atmosphère. D’après les conventions faites, E0 est, on le voit, positif si l’oxydant du couple est plus fort que l’oxydant H+, négatif dans le cas contraire. Le tableau ci-joint donne les valeurs à 25 °C des potentiels normaux d’un certain nombre de couples redox. Sur ce tableau lu de haut en bas, les oxydants sont rangés par force décroissante, le plus fort étant le fluor ; à l’inverse, les réducteurs conjugués sont de force croissante, les plus forts étant les métaux alcalins. En principe, l’oxydant d’un couple peut oxyder les réducteurs de tous les couples situés au-dessous de lui ; d’une façon plus précise, on peut, à l’aide de la formule de Nernst, prévoir l’évolution d’une réaction d’oxydoréduction en solution, ainsi que l’équilibre chimique qui peut résulter. En effet, pour la pile
E0 est la tension normale redox de ce couple ; elle ne dépend pour celui-ci que de la température, la pression étant de 1 atmosphère. D’après les conventions faites, E0 est, on le voit, positif si l’oxydant du couple est plus fort que l’oxydant H+, négatif dans le cas contraire. Le tableau ci-joint donne les valeurs à 25 °C des potentiels normaux d’un certain nombre de couples redox. Sur ce tableau lu de haut en bas, les oxydants sont rangés par force décroissante, le plus fort étant le fluor ; à l’inverse, les réducteurs conjugués sont de force croissante, les plus forts étant les métaux alcalins. En principe, l’oxydant d’un couple peut oxyder les réducteurs de tous les couples situés au-dessous de lui ; d’une façon plus précise, on peut, à l’aide de la formule de Nernst, prévoir l’évolution d’une réaction d’oxydoréduction en solution, ainsi que l’équilibre chimique qui peut résulter. En effet, pour la pile
la d. d. p. VA1 – VA2 est donnée, d’après ce qui précède par : , laquelle est positive si A1 est cathode, c’est-à-dire si ox1 est réduit lors du fonctionnement de la pile. Dès lors, dans un mélange en solution des quatre corps — avec mêmes activités que dans la pile —, la réaction évoluera dans le sens : ox1 + red2 → ox2 + red1 tant que l’expression de VA1 – VA2 sera positive ; un équilibre d’oxydoréduction correspondra à une valeur nulle de la f. é. m. de la pile ; ce qui, à 25 °C (298 K), conduit à
, laquelle est positive si A1 est cathode, c’est-à-dire si ox1 est réduit lors du fonctionnement de la pile. Dès lors, dans un mélange en solution des quatre corps — avec mêmes activités que dans la pile —, la réaction évoluera dans le sens : ox1 + red2 → ox2 + red1 tant que l’expression de VA1 – VA2 sera positive ; un équilibre d’oxydoréduction correspondra à une valeur nulle de la f. é. m. de la pile ; ce qui, à 25 °C (298 K), conduit à
On voit en particulier que la réaction pourra être considérée comme totale dans le sens indiqué si le deuxième membre de l’expression précédente est négatif, et assez grand en valeur absolue ; une première et grossière approximation consiste à admettre qu’il en est ainsi lorsque
Remarque
Le remplacement dans la formule de Nernst des activités en fonction des molarités conduit à :
où E0′, potentiel normal apparent, n’est pas constant à T donné, mais dépend aussi des coefficients d’activité* des électrolytes en solution, et peut différer de E0 de plusieurs dixièmes de volt.

Influence du pH
Il arrive assez souvent que le pH ait une influence sur les réactions d’oxydoréduction. C’est en particulier le cas lorsque l’ion H+ figure explicitement dans l’écriture d’un couple redox, par exemple :
pour lequel
on voit que, toutes choses égales d’ailleurs, E augmente, et avec lui le pouvoir oxydant de la solution, quand le pH diminue. Un autre exemple est celui du couple H2/H+, pour lequel E = – 0,059.pH ; remarquons que l’ion H+ est oxydant pour les seuls métaux des couples Me/Men+ situés au-dessous de lui dans le tableau, ce qui veut dire que ces métaux sont les seuls à dégager de l’hydrogène au contact des acides dilués.
Amphotères
Il arrive que l’oxydant d’un couple redox soit aussi le réducteur d’un autre couple. C’est le cas de l’iode dans les couples I–/I2 et  celui de l’ion ferreux dans les couples Fe/Fe2+ et Fe2+/Fe3+ ; l’iode, l’ion ferreux sont des amphotères, que l’on rencontre de façon plus générale dans le cas d’éléments possédant plus de deux degrés d’oxydation. Il arrive que dans certaines conditions, qui tiennent ordinairement à la valeur du pH, l’amphotère ne soit pas stable : il réagit sur lui-même pour donner à la fois le réducteur du premier couple et l’oxydant du second : il y a dismutation de l’amphotère. C’est le cas de l’iode en milieu basique :
celui de l’ion ferreux dans les couples Fe/Fe2+ et Fe2+/Fe3+ ; l’iode, l’ion ferreux sont des amphotères, que l’on rencontre de façon plus générale dans le cas d’éléments possédant plus de deux degrés d’oxydation. Il arrive que dans certaines conditions, qui tiennent ordinairement à la valeur du pH, l’amphotère ne soit pas stable : il réagit sur lui-même pour donner à la fois le réducteur du premier couple et l’oxydant du second : il y a dismutation de l’amphotère. C’est le cas de l’iode en milieu basique :
alors qu’en milieu acide c’est la réaction opposée, dite « d’amphotérisation », qui se produit :
L’eau est considérée comme amphotère, pour une raison un peu différente : combinaison de 2H+ et de O2–, elle est oxydante suivant le couple 2H+ + 2e– ⇄ H2 et réductrice suivant le potentiel normal redox du premier couple est nul, celui du second vaut + 1,23 volt ; il n’est donc pas étonnant que des oxydants forts comme le fluor ou des réducteurs forts comme les métaux alcalins ne puissent exister au contact de l’eau ; mais, en dehors des cas extrêmes, les réactions de l’eau avec oxydants ou réducteurs sont lentes, ce qui rend négligeable l’action de l’eau. Rappelons enfin que l’aluminium, métal très réducteur, reste pratiquement inaltéré au contact de l’eau, bien que les potentiels redox des couples Al/Al3+ et Al/ion aluminate soient fortement négatifs : cette inertie est due à la formation d’une mince couche d’hydrargillite Al(OH)3 imperméable ; il y a passivation du métal. Mais le pH joue ici encore un rôle important, et la passivation de l’aluminium cesse au contact des solutions acides de pH < 4 ou basiques de pH > 9 ; de l’hydrogène se dégage, et le métal subit une corrosion.
le potentiel normal redox du premier couple est nul, celui du second vaut + 1,23 volt ; il n’est donc pas étonnant que des oxydants forts comme le fluor ou des réducteurs forts comme les métaux alcalins ne puissent exister au contact de l’eau ; mais, en dehors des cas extrêmes, les réactions de l’eau avec oxydants ou réducteurs sont lentes, ce qui rend négligeable l’action de l’eau. Rappelons enfin que l’aluminium, métal très réducteur, reste pratiquement inaltéré au contact de l’eau, bien que les potentiels redox des couples Al/Al3+ et Al/ion aluminate soient fortement négatifs : cette inertie est due à la formation d’une mince couche d’hydrargillite Al(OH)3 imperméable ; il y a passivation du métal. Mais le pH joue ici encore un rôle important, et la passivation de l’aluminium cesse au contact des solutions acides de pH < 4 ou basiques de pH > 9 ; de l’hydrogène se dégage, et le métal subit une corrosion.





