accumulateur électrique (suite)
Pendant la décharge, le peroxyde des plaques positives est réduit à l’état de PbO et le plomb des négatives oxydé en PbO. Cet oxyde réagit aux deux électrodes avec l’acide sulfurique pour se transformer en sulfate ; d’où le nom de réaction de double sulfatation représentant le mécanisme suivant :
PbO2 + Pb + 2 H2SO4 → 2 PbSO4 + 2 H2O.
Pendant la charge, les réactions inverses se produisent. On voit que l’électrolyte prend part à la réaction ; sa concentration décroît pendant la décharge, ce qui présente un avantage important, puisqu’il devient possible d’apprécier l’état de charge de l’accumulateur par une mesure de la densité de son électrolyte.

Accumulateurs alcalins
L’électrolyte est constitué d’une solution de potasse à la concentration d’environ 25 p. 100. Dans l’accumulateur fer-nickel (Edison), la matière positive est à base d’oxyde de nickel, additionnée, pour la rendre plus conductrice, de paillettes de nickel ou de graphite, et la matière négative est du fer réduit. À la charge et à la décharge, deux réactions inverses se produisent, que l’on peut représenter par l’équation simplifiée
2 Ni(OH)3 + Fe ⇄ 2 Ni(OH)2 + Fe(OH)2.
On voit que, pendant la décharge, l’oxyde de nickel est réduit et que le fer est oxydé, l’électrolyte ne prenant pas part à la réaction.
L’accumulateur au cadmium-nickel (Jungner) ne diffère essentiellement du précédent que par le remplacement du fer par du cadmium.
Dans l’accumulateur à l’argent, la matière positive est constituée d’oxydes d’argent (AgO ou mélange d’AgO et d’Ag2O) et la matière négative de zinc, avec, à la décharge et à la charge, les doubles réactions suivantes :
AgO + Zn + H2O ⇄ Ag + Zn(OH)2 ;
Ag2O + Zn + H2O ⇄ 2 Ag + Zn(OH)2.
Dans cet élément, la solubilité de Zn(OH)2 dans l’électrolyte est un inconvénient que l’on combat par diverses astuces de construction.
La grille ou support de matière active des éléments alcalins peut présenter des formes très différentes : pochettes perforées en acier nickelé, tubes constitués par l’enroulement d’un ruban d’acier nickelé et perforé, grille métallique sur laquelle on dépose la matière active ou encore grille garnie de matière active frittée dans le cas des éléments à plaques extra-minces.
Les bacs sont généralement en acier et plus rarement en matière plastique ; dans le premier cas, ils sont isolés électriquement des électrodes.
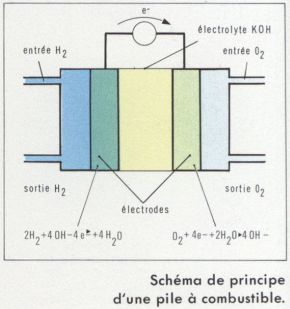
Caractéristiques électriques et comparaison des différents types d’accumulateurs
Un accumulateur est défini par sa capacité et sa tension. La capacité est le nombre d’ampères-heures que l’accumulateur peut débiter dans des conditions de décharge déterminées. On utilise fréquemment un autre paramètre : la capacité massique, qui est le nombre d’ampères-heures que peut fournir un élément par unité de poids.
La force électromotrice d’un accumulateur est une valeur qui dépend du couple adopté et se calcule théoriquement par l’application des lois de la thermodynamique. Elle est de 2,04 volts pour l’accumulateur au plomb, de 1,30 volt pour les éléments au cadmium-nickel et de 1,59 volt pour l’élément à l’argent. Il s’agit là de la tension en circuit ouvert. Si, au contraire, il y a passage de courant, la tension aux bornes est diminuée (en décharge) ou augmentée (en charge) d’une valeur égale à iR, i étant le courant en ampères qui circule dans l’élément et R sa résistance en ohms.
On voit donc que la tension d’un élément dépend de son régime de charge ou de décharge. La figure 1 montre la variation de la tension en fonction du régime et de la durée de décharge de l’accumulateur au plomb ; la figure 2 et la figure 3 correspondent respectivement à un accumulateur alcalin cadmium-nickel et à un accumulateur à l’argent. Pendant la décharge, il ne faut jamais dépasser une tension limite inférieure pour ne pas risquer d’abîmer l’élément.

Par la combinaison de la capacité massique et de la tension moyenne en décharge, on peut calculer un autre paramètre : l’énergie massique, ou nombre de watts-heures au kilogramme qu’un accumulateur peut fournir dans des conditions de décharge données. La figure 4 permet la comparaison des énergies massiques de différents types d’accumulateurs en fonction du régime de décharge.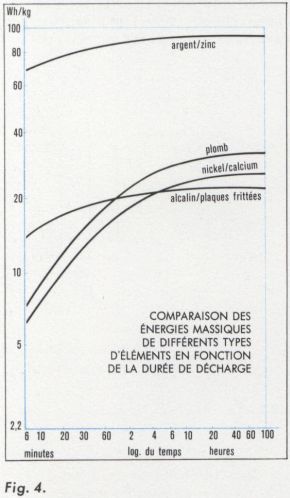
Cependant, dans une comparaison pratique, d’autres facteurs doivent intervenir :
— la durée de service utile, c’est-à-dire le nombre de cycles de charge et de décharge que peut subir un élément avant sa mise hors service. Cette propriété diminue dans l’ordre : éléments alcalins, au plomb et à l’argent ;
— la robustesse d’emploi, c’est-à-dire la simplicité de l’entretien, la facilité et la rapidité de charge, la possibilité d’abandons prolongés en période de non-utilisation. Pour cette caractéristique, l’ordre de classement est à peu près le même ;
— le poids et l’encombrement. L’élément à l’argent est très favorisé ; l’élément au plomb et les éléments alcalins sont voisins, car le poids plus réduit de ces derniers est compensé par une tension plus faible, ce qui augmente le nombre d’éléments à grouper pour obtenir une tension donnée ;
— le comportement aux hautes et basses températures. D’importants progrès ont été réalisés dans ce domaine, mais l’accumulateur à l’argent bénéficie d’un échauffement interne pendant son fonctionnement qui lui permet de mieux supporter de basses températures ;
— les possibilités de décharge à fort régime ; les éléments à l’argent et les éléments alcalins à plaques frittées présentent une nette supériorité ;
— le prix, qui augmente dans l’ordre : éléments au plomb, alcalins ou à l’argent.
L’inventeur des accumulateurs
Gaston Planté, électricien français (Orthez 1834 - Bellevue, Seine-et-Oise, 1889). D’abord préparateur de physique d’Edmond Becquerel (1854), il entra dans les laboratoires de Christofle, où il perfectionna la galvanoplastie. En 1859, il inventa les accumulateurs au plomb, qui lui permirent d’obtenir, pour la première fois, des courants intenses sous de faibles tensions.




