énergie
Grandeur que possède un système mécanique quand il est capable de produire du travail.
Généralités
Il en est ainsi de l’eau stockée en amont d’un barrage : elle peut, en perdant de l’altitude, actionner une turbine ; son énergie est qualifiée de potentielle, car elle est due à sa position ; l’énergie des masses d’air en mouvement, du vent qui actionne moulins et voiliers, est qualifiée de cinétique, car elle est due à la vitesse de ces masses d’air. Dans un cas comme dans l’autre, on convient de mesurer la diminution d’énergie d’un système mécanique par le travail qu’il a produit : une masse d’eau M, de poids Mg, peut fournir en tombant d’une hauteur h le travail  qui est aussi la diminution de son énergie potentielle ; dans le cas où la production de travail a son origine dans la diminution de la vitesse v d’un système mécanique, il résulte du théorème de l’énergie cinétique que le travail produit est mesuré par la diminution de l’expression
qui est aussi la diminution de son énergie potentielle ; dans le cas où la production de travail a son origine dans la diminution de la vitesse v d’un système mécanique, il résulte du théorème de l’énergie cinétique que le travail produit est mesuré par la diminution de l’expression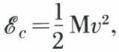
appelée énergie cinétique du système mécanique.
Dans les phénomènes purement mécaniques, en l’absence de frottements, il y a conservation de l’énergie mécanique. Le mouvement d’un pendule dans le vide, sans frottement sur le support, en offre un exemple : l’énergie du pendule, purement potentielle au maximum d’élongation, où la vitesse est nulle, devient progressivement cinétique pendant que le pendule descend, puis de nouveau potentielle quant il remonte de l’autre côté, etc., la somme
demeurant constante au cours du mouvement.
Dans la plupart des phénomènes naturels, cependant, l’énergie mécanique ne se conserve pas. Elle disparaît plus ou moins vite, mais on observe que cette disparition est accompagnée de la production d’une certaine quantité de chaleur : le projectile qui s’écrase sur une plaque de blindage ne produit pas de travail, mais sa température s’élève notablement ; il en serait de même des patins de freins d’un véhicule qui descendrait une côte à vitesse constante, moteur débrayé. À l’inverse, dans les moteurs thermiques, on constate que la disparition d’une certaine quantité de chaleur accompagne le travail produit. Le premier principe de la thermodynamique, suggéré par de nombreuses mesures (v. équivalent mécanique), affirme l’équivalence du travail et de la chaleur. L’un de ses énoncés, dit « principe de l’équivalence », affirme que : si un système revient à son état initial après un cycle de transformations au cours duquel il n’a échangé avec le milieu extérieur que du travail mécanique et de la chaleur, il a reçu du travail s’il a fourni de la chaleur (et inversement), et il existe entre ce travail, mesuré en joules, et cette chaleur, mesurée en calories, un rapport constant J = 4,185 J/cal, dit « équivalent mécanique de la calorie » ; dès lors, si l’on convient d’exprimer, en utilisant le rapport de transformation précédent, les quantités de chaleur en joules, le principe de l’équivalence s’écrit, pour un cycle : W + Q = 0, W, travail mécanique, et Q, quantité de chaleur, étant des grandeurs algébriques, positives quand elles sont reçues par le système, négatives quand elles sont fournies par lui. Un autre énoncé du même principe, dit « principe de l’état initial et de l’état final », affirme de manière un peu différente cette équivalence : la somme W + Q du travail et de la chaleur reçus par un système passant d’un état initial (1) à un état final (2) ne dépend que de ces états, et non pas du détail des transformations intermédiaires ; celles-ci influent sur les valeurs de W et de Q, mais pas sur leur somme. Il est fréquent que l’énergie d’un système puisse, selon les circonstances, se manifester par la fourniture soit de travail, soit de chaleur : l’énergie d’un gaz par exemple peut apparaître sous forme de travail si le gaz est au contact d’un milieu où la pression est moindre que celle du gaz, sous forme de chaleur si le gaz est au contact d’un milieu dont la température est moindre que celle du gaz. À l’inverse, on peut accroître l’énergie d’un corps en lui fournissant soit du travail, soit de la chaleur, ou les deux simultanément ; et l’accroissement d’énergie une fois acquis, il n’est souvent pas possible de dire par quelle fourniture il a été obtenu.
Tout corps apparaît ainsi, du fait de sa position, de sa vitesse, de sa pression, de sa température, comme un réservoir d’énergie. En thermodynamique, où l’on fait ordinairement abstraction de l’énergie due à la position et à la vitesse, on définit pour un système son énergie interne comme une fonction U des variables qui définissent chacun des états du système (fonction d’état), et dont la variation ΔU, d’un état initial (1) à un état final (2) de ce système, est égale à la somme W + Q, qui est, d’après le premier principe, parfaitement définie. On a donc, en désignant par U1 et U2 respectivement les énergies internes du système dans les états (1) et (2) :
U2 – U1 = ΔU = W + Q.
On remarquera que, ainsi définie, la fonction U n’est connue qu’à une constante arbitraire près ; seules ses variations sont déterminées.
• Généralisation. Les échanges de chaleur et de travail mécanique, en particulier travail des forces de pression, sont les plus fréquemment invoqués en thermodynamique. Ce ne sont cependant pas les seuls susceptibles de faire varier l’énergie interne d’un système ; ce dernier peut en effet comporter un générateur (pile, accumulateur, dynamo) ou un récepteur (moteur, cuve à électrolyse, condensateur, résistance) de courant électrique et, par l’intermédiaire de ce courant, fournir et consommer du travail mécanique et de la chaleur ; on dit du courant électrique qu’il véhicule de l’énergie, qu’on nomme électrique et que l’on mesure par le travail ou la chaleur qu’on peut en obtenir ; un système peut donc éprouver des variations de son énergie interne par des apports ou des retraits d’énergie électrique. De même, les phénomènes de rayonnement électromagnétique dans les différents domaines de longueurs d’onde constituent un moyen efficace d’échange d’énergie entre les corps : il n’est pour s’en convaincre que de considérer le rayonnement solaire, lequel est à l’origine de la plupart de nos sources actuelles d’énergie. Tous ces échanges, qu’ils soient mécaniques, calorifiques, électriques ou de rayonnement, peuvent contribuer aux variations de l’énergie interne d’un corps, ce qu’on écrit :
ΔU = W + Q + Σw,
Σw représentant la somme des échanges dus aux variétés d’énergie autres que la chaleur (Q) et le travail des forces de pression (W).
L’énergie interne d’un système isolé ne varie pas ; celui-ci ne peut, par définition, échanger avec l’extérieur aucune variété d’énergie. Bien que le concept en soit important en thermodynamique, il n’existe pas en fait dans l’Univers de système isolé.




