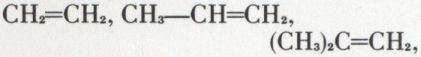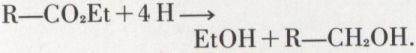Nom donné aux dérivés hydroxylés d’un hydrocarbure, pourvu que l’hydroxyle soit relié à un carbone saturé :
CH3—CH2OH (alcool éthylique),
CH2=CH—CH2OH (alcool allylique),
C6H5—CH2OH (alcool benzylique),
etc.
La nomenclature officielle attribue aux alcools le nom de l’hydrocarbure dont ils dérivent, dans lequel l’e final fait place à la désinence ol ; un numérotage est le plus souvent nécessaire.

Mais bien des alcools sont communément désignés par le mot alcool suivi d’un adjectif évoquant l’une de ses origines (alcool éthylique).
Il est également pratique de considérer les alcools comme des dérivés de substitution du plus simple d’entre eux, le méthanol CH3OH, alors appelé carbinol :
CH2=CH—CHOH—CH3 : méthyl-vinyl-carbinol,
(C6H5)3COH : triphénylcarbinol.
La nature nous fournit de nombreux alcools : éthanol et quelques homologues dans la fermentation alcoolique, alcools terpéniques ou aromatiques dans les huiles essentielles, alcools estérifiés dans ces huiles, dans les cires, dans le suint du mouton, etc.
Cependant, beaucoup de ces sources naturelles font place à la synthèse. Citons quelques méthodes :
1. L’hydrolyse des éthers halohydriques, dont quelques-uns résultent de l’halogénation des hydrocarbures :

Elle s’opère généralement en présence d’alcali.
2. L’hydratation sulfurique des alcènes, qui permet en particulier, à partir des 3 alcènes présents dans le gaz de craquage :
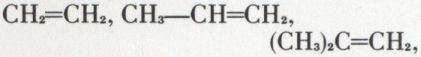
l’accès pratique aux alcools :

3. L’hydrogénation des dérivés carbonylés :

Elle s’opère généralement par voie catalytique (Ni, Pt).
L’hydrogénation sous forte pression de l’oxyde de carbone en présence de chromite de zinc est la meilleure préparation du méthanol.
4. Les méthodes synthétiques, qui, au laboratoire au moins, sont les plus utilisées ; on oppose à un organomagnésien RMgX un dérivé carbonylé, un ester, un époxyde, etc. :

Enfin, les esters sont réductibles (Na + EtOH ou catalyse sur Cr2O3, ZnO) en deux alcools, dont l’un est obligatoirement primaire :
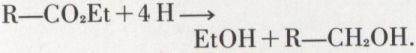
Propriétés physiques
Les alcools sont des molécules associées par liaison hydrogène

Cette association amène un point d’ébullition déjà élevé pour les premiers termes :

et, dans la série linéaire, une augmentation sensiblement constante (19 °C) du point d’ébullition lorsqu’on ajoute un carbone supplémentaire ; cela les distingue de la série des alcanes normaux, molécules non associées.
Les alcools cristallisent difficilement, exception faite des alcools tertiaires symétriques : (CH3)3COH fond à 25 °C.
Les densités des alcools saturés sont comprises entre 0,80 et 0,85, les indices de réfraction ne dépassent guère 1,42.
Les alcools en C1, C2, C3 et plusieurs alcools en C4 sont miscibles à l’eau en toutes proportions et dissolvent également la plupart des substances organiques liposolubles ; l’éthanol est un bon solvant de miscibilité, mais le méthanol n’est que partiellement miscible aux hydrocarbures. Les premiers termes dissolvent les alcalis caustiques, l’iode (solution brune), les nitrites alcalins, l’iodure de potassium ainsi que des substances organiques riches en oxygène et insolubles dans les hydrocarbures : diacides, acides-alcools, sucres, etc. Par contre les sulfates, phosphates et carbonates, même alcalins, sont insolubles dans les alcools, de même que la baryte hydratée. En infrarouge, les alcools primaires et secondaires présentent une bande d’absorption forte et large dans la région 3 400 cm–1, laquelle correspond à la liaison O—H associée ; chez les alcools tertiaires encombrés, cette bande se situe vers 3 500 cm–1 et devient fine (liaison O—H non associée).
Propriétés chimiques
Tant qu’il s’agit d’alcools saturés, ROH, le radical R n’intervient jamais dans les réactions aussi longtemps que la fonction alcool reste intacte ; il convient donc seulement d’envisager deux types principaux de réactions : celles qui coupent la molécule entre RO et H, celles qui coupent la molécule entre R et OH, avec la combinaison des deux types de coupure et, éventuellement, la participation des hydrogènes du radical R.
Acidité
La réaction équilibrée

permet de déterminer une constante dite « d’autoprotolyse », exprimée généralement par son cologarithme décimal, le pKA ; celui-ci est de l’ordre de 18 pour les alcools primaires, alors que la constante d’autoprotolyse de l’eau est de 15,7 ; le pKA des alcools tertiaires est nettement plus élevé.
Il semblerait en résulter que les alcools primaires sont environ 200 fois moins acides que l’eau. En réalité, l’équilibre

a pu être étudié et il est beaucoup plus favorable à la formation de l’ion alcoolate R—O– ; il montre que l’éthanol n’est en réalité que 4 fois moins acide que l’eau, ce qui explique la préparation industrielle de l’éthylate de sodium EtONa par action de la soude NaOH sur un excès d’alcool éthylique absolu ; par distillation d’une partie de l’alcool, celui-ci entraîne l’eau sous forme d’azéotrope à 5 p. 100 d’eau, ce qui déplace l’équilibre en faveur de l’éthylate.
Toutefois, les alcoolates se forment plus généralement par l’action du sodium sur l’alcool :

ou par celle de l’amidure de sodium :

Les chlorures d’acides transforment les alcools primaires en esters :