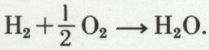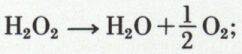Augmentation de la vitesse d’une réaction chimique créée par le contact d’un corps (catalyseur) étranger au bilan de cette réaction.
Généralités
Ainsi un mélange d’hydrogène et d’oxygène, abandonné à lui-même à la température ordinaire, ne réagit pas, même au bout d’un temps très long ; mais si on y introduit un fragment de mousse de platine, on observe aussitôt la formation d’eau, en même temps que la mousse de platine, échauffée par la réaction exothermique qui se produit à son contact, devient incandescente ; on dit que le platine en mousse est un catalyseur de la réaction
La notion de catalyseur, bien qu’obscurément ressentie déjà par les alchimistes, ne s’est précisée qu’au début du xixe s., époque à laquelle Berzelius* inventa, pour en parler, le mot de catalyse (1835).
Le mode d’action du catalyseur est demeuré longtemps mystérieux, du fait que celui-ci n’est ni consommé ni même altéré par la réaction qu’il accélère et peut ainsi catalyser une réaction portant sur des masses beaucoup plus grandes que la sienne ; le mystère est cependant dissipé, car on sait maintenant que l’indifférence du catalyseur n’est qu’apparente et qu’il intervient comme intermédiaire efficace dans la réaction qu’il catalyse ; on est ainsi ramené à un problème de cinétique chimique et de mécanisme réactionnel.
L’interprétation cinétique du mode d’action du catalyseur oblige à distinguer deux sortes de catalyse : homogène, quand le catalyseur forme avec les corps qui réagissent et les produits un mélange homogène, donc monophasé, gazeux ou liquide ; hétérogène, quand le catalyseur, ordinairement solide, forme une phase distincte de celle constituée par le mélange en réaction : la formation d’eau en présence du platine est un exemple de catalyse hétérogène, alors que l’action d’un acide sur la vitesse d’inversion du saccharose est un cas de catalyse homogène.
L’action catalytique présente certains caractères généraux dont l’un concerne les réactions limitées : l’expérience montre que le catalyseur ne modifie pas, par sa présence, l’équilibre qui s’établirait, plus lentement, en son absence ; la composition du mélange à l’équilibre reste la même ; c’est là d’ailleurs un caractère en accord avec les principes thermodynamiques. Il en résulte que, l’équilibre étant considéré comme la limite commune de deux réactions inverses, le catalyseur est actif pour l’une comme pour l’autre ; ainsi le fer, catalyseur de la décomposition thermique du gaz ammoniac en ses éléments, est également un catalyseur de la synthèse du gaz ammoniac.
Ainsi le catalyseur, incapable à lui seul de modifier un équilibre, ne crée pas l’affinité ; il « éveille les affinités assoupies » ; il serait vain de vouloir découvrir un catalyseur pour une réaction si celle-ci, dans les conditions où l’on veut la faire, n’est pas thermodynamiquement possible, c’est-à-dire ne correspond pas à une diminution de l’énergie libre.
Un autre caractère important de l’action du catalyseur est la spécificité : un mélange de corps capables de réagir, placé dans des conditions données de température et de pression, peut souvent évoluer de plusieurs façons différentes, en d’autres termes être le siège de plusieurs réactions simultanées : un catalyseur donné accélère une seule d’entre elles et oriente ainsi l’évolution du mélange vers des produits déterminés ; ainsi, vers 200 °C, l’acide formique éprouve simultanément les deux décompositions suivantes :

en présence d’alumine, seule la première transformation (déshydratation) est constatée, alors qu’en présence d’oxyde de zinc c’est la seconde (déshydrogénation) qui se produit. Un autre exemple est celui des mélanges de monoxyde de carbone et d’hydrogène (gaz de synthèse), dont les possibilités de réaction sont nombreuses, en particulier suivant la nature du catalyseur utilisé. Signalons enfin la très grande spécificité des catalyseurs biochimiques, ou enzymes.
Catalyse homogène
Le mélange homogène contenant le catalyseur est gazeux, ou plus fréquemment liquide ; le catalyseur peut être une molécule ; il est plus souvent un ion : ainsi les ions iodure I–, les ions Fe3+ catalysent la décomposition de l’eau oxygénée suivant la réaction :
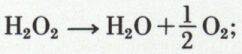
les ions H+ catalysent l’inversion du saccharose, l’estérification des alcools, l’hydrolyse des esters ; les ions OH– catalysent aussi l’hydrolyse des esters, etc.