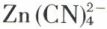Métal blanc d’usage courant.
Le zinc et ses dérivés
État naturel
On a trouvé des traces de zinc natif en Australie, mais le minerai principal est actuellement la blende ZnS. On connaît aussi à l’état naturel la calamine ZnCO3, des silicates, l’oxyde (rare) et une ferrite (franklinite) Zn(FeO2)2. Le zinc constitue 0,02 p. 100 de la lithosphère.
Atome
Le numéro atomique est 30, et la structure électronique de l’état fondamental de l’atome est 1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s2. Il en résulte les énergies suivantes d’ionisation : 9,4 eV pour le premier électron et 17,9 eV pour le second. Le rayon atomique est de 1,25 Å, et le rayon du cation Zn+2 de 0,74 Å.
Corps simple
Le zinc est un solide qui fond à 419 °C et dont la température normale d’ébullition est voisine de 907 °C, c’est-à-dire que c’est un corps assez volatil. C’est un métal usuel assez mou, dont les propriétés mécaniques sont fortement influencées par les impuretés. On en fait ainsi des feuilles qui servent à la couverture d’immeubles. Mais, à chaud, le zinc réagit vivement avec l’oxygène, les halogènes et le soufre. Il est attaqué par l’acide chlorhydrique et l’acide sulfurique usuels. Il réagit sur les bases alcalines en donnant un zincate et un dégagement d’hydrogène :
Zn + 2 NaOH → Zn(ONa)2 + H2.
Il forme des organozinciques symétriques R—Zn—R ou mixtes R—Zn—X (R représente un radical hydrocarboné, et X un halogène).
Principaux dérivés
L’oxyde ZnO est assez volatil. Il peut prendre une teinte légèrement jaune sous l’effet d’une légère dissociation avec perte d’oxygène, ce qui lui donne une composition légèrement non stœchiométrique du type ZnO1–x (x étant petit). L’hydroxyde Zn (OH)2 est amphotère, c’est-à-dire qu’il se dissout dans les acides en donnant un sel de zinc et qu’il se dissout dans les bases alcalines en donnant un zincate tel que Zn (ONa)2 ou Zn (OK)2.
Souvent, les sels de zinc cristallisent à l’état hydraté de leurs solutions aqueuses, et l’on a souvent des hydrates contenant l’ion solvaté 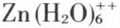 On connaît différents sels complexes, tels que des halogénures contenant l’ion
On connaît différents sels complexes, tels que des halogénures contenant l’ion  ou des cyanures contenant l’ion
ou des cyanures contenant l’ion 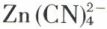
H. B.
La métallurgie
Dans l’Antiquité, le zinc était utilisé sous forme alliée et entrait dans la composition de nombreux bronzes et laitons. L’airain, de composition très variable, contenait essentiellement du cuivre, de l’étain et du zinc ; il était élaboré directement par réduction du mélange des minerais métalliques. Le laiton était travaillé dans le nord de la Gaule, mais c’est à la fin du Moyen Âge que naquit son façonnage dans la région de Dinant pour les travaux de chaudronnerie, ou dinanderie. Bien que connu au Moyen Âge en Chine et en Inde, d’où on l’importait, le zinc était alors considéré en Europe comme une précieuse variété d’étain ; d’où son nom dérivé du mot germanique zinn (étain). L’alchimiste Paracelse (v. 1493-1541) le mentionna le premier au début du xvie s. sous le nom de zincum. En 1743, la première usine d’extraction du zinc par distillation à partir de la calamine fut mise en exploitation à Bristol. Mais c’est le chimiste belge l’abbé Jean-Jacques Daniel Dony (1759-1819) qui industrialisa en 1808 dans l’usine de Liège (Vieille-Montagne) le procédé de réduction et de distillation, dit procédé liégeois.
Principaux minerais
Le principal minerai de zinc est la blende, sulfure de zinc ZnS titrant de 30 à 50 p. 100 de zinc, mondialement réparti, mais dont les gisements les plus importants sont au Canada ; la blende est fréquemment mélangée de silice, de chaux, de sulfure de plomb (galène PbS), de sulfure de fer (pyrite FeS) et de sulfure de cadmium (CdS). Un autre minerai, aujourd’hui moins répandu, la calamine, est un mélange à base de carbonate de zinc (smithsonite ZnCO3) contenant du silicate de zinc (willemite Zn2SiO4).





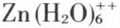 On connaît différents sels complexes, tels que des halogénures contenant l’ion
On connaît différents sels complexes, tels que des halogénures contenant l’ion  ou des cyanures contenant l’ion
ou des cyanures contenant l’ion