structure chimique (suite)
La structure des alliages, formés de l’union de métaux entre eux ou avec un non-métal, est analogue à celle des métaux purs, en ce que c’est aussi la liaison métallique qui assure leur cohésion ; mais l’agencement des atomes peut subir des modifications suivant la composition ; de ce point de vue et dans le cas des alliages binaires, on distingue :
— les solutions solides de deux métaux, tels que Ag-Au, Cu-Ni, dans le cas où les réseaux des métaux purs sont du même type et les mailles de dimensions voisines ; on observe seulement, en fonction de la composition de l’alliage, une variation continue des dimensions de la maille ;
— les solutions solides d’insertion, dans lesquelles quelques atomes seulement sont de dimension assez faible pour pouvoir s’insérer dans les vides cristallographiques du réseau de certains métaux, en y créant seulement une légère distorsion ; c’est le cas de l’azote ou du carbone dans le réseau du fer, de l’hydrogène dans celui du palladium ; bien qu’on emploie quelquefois pour ces corps les termes de nitrure, de carbure, d’hydrure (interstitiel), on ne saurait les considérer comme des composés définis ;
— les composés intermétalliques, qui correspondent aux cas où, les métaux constituants ayant des structures différentes, la variation progressive de composition de l’alliage fait apparaître des « phases » successives, α, β, γ, ε, η, de structures différentes ; à chacune on peut associer un composé électronique de formule définie, parfois compliquée ; il en est ainsi pour les laitons ;β(CuZn), γ(Cu5Zn8), ε(CuZn3). Les mêmes phases intermédiaires β, γ, ε se rencontrent pour un certain nombre d’autres alliages binaires ; W. Hume-Rothery a établi pour chacune d’elles l’existence d’un rapport constant (respectivement 3/2, 21/13, 7/4) entre le nombre d’électrons de valence et le nombre d’atomes du composé intermétallique.
Structures macromoléculaires et macro-ioniques
On rencontre dans toute la chimie, tant minérale qu’organique, des macromolécules* et des macro-ions ; la connaissance de leur structure est d’abord celle du motif et de sa répétition, puis, le cas échéant, celle du cristal macromoléculaire ou macro-ionique.
Du point de vue structural, on distingue :
— les macromolécules et les macro-ions filiformes ou unidimensionnels (par exemple le soufre μ, le polyéthylène, la cellulose, etc.) ; l’asbeste (amiante), silicate double de calcium et de magnésium, offre l’exemple de macro-ions unidimensionnels  (fig. 6) ;
(fig. 6) ;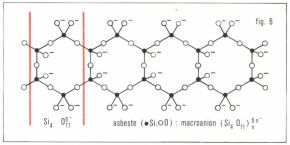
— les macromolécules et les macro-ions lamellaires ou bidimensionnels, dont le graphite fournit un exemple (fig. 7) ; les atomes de carbone y sont disposés, dans des plans parallèles, suivant un pavage hexagonal régulier, constituant ainsi dans chaque plan une macromolécule bidimensionnelle Cn, dans laquelle chaque atome C échange avec ses proches voisins, distants de 1,42 Å, trois fortes liaisons de covalence orientées à 120° par hybridation trigonale sp2 ; de plan à plan, par contre, la distance est plus grande (3,4 Å) et la cohésion beaucoup plus faible, ce qui donne au graphite son caractère onctueux au toucher et ses propriétés lubrifiantes. Une orbitale délocalisée s’étendant à l’ensemble des atomes d’un plan rassemble les électrons, un par atome C, qui ne participent pas à l’hybridation précédente ; il en résulte pour le graphite (cf. métaux) une bonne conductibilité électrique dans les directions parallèles aux feuillets.
De même, des silicates comme le talc, des silico-aluminates comme les micas, aisément clivables, et les argiles ont une structure macro-ionique lamellaire : les argiles sont formées de macroanions 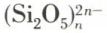 et de macrocations
et de macrocations  disposés en feuillets parallèles et alternés, entre lesquels la pénétration de molécules d’eau amène gonflement et plasticité ; les macromolécules et les macro-ions tridimensionnels : le diamant, cristal atomique où toutes les liaisons sont identiques, en fournit un exemple ; de même la silice, cristallisée ou non. Les feldspaths, les zéolites, silico-aluminates, renferment des macro-ions tridimensionnels : la structure d’une zéolite se conçoit, schématiquement, en imaginant que dans la silice un certain nombre d’atomes 14Si soient remplacés, sans grande déformation, par autant d’atomes 13Al, dont le noyau renferme une charge positive de moins que celui de Si, dont il prend la place. Il en résulte pour l’ensemble une charge négative : on a un macroanion tridimensionnel de silico-aluminate ; la neutralité électrique étant assurée par des microcations tels que K+, Ca2+, etc., aisément interchangeables, on explique ainsi l’emploi des zéolites comme adoucisseurs d’eaux naturelles.
disposés en feuillets parallèles et alternés, entre lesquels la pénétration de molécules d’eau amène gonflement et plasticité ; les macromolécules et les macro-ions tridimensionnels : le diamant, cristal atomique où toutes les liaisons sont identiques, en fournit un exemple ; de même la silice, cristallisée ou non. Les feldspaths, les zéolites, silico-aluminates, renferment des macro-ions tridimensionnels : la structure d’une zéolite se conçoit, schématiquement, en imaginant que dans la silice un certain nombre d’atomes 14Si soient remplacés, sans grande déformation, par autant d’atomes 13Al, dont le noyau renferme une charge positive de moins que celui de Si, dont il prend la place. Il en résulte pour l’ensemble une charge négative : on a un macroanion tridimensionnel de silico-aluminate ; la neutralité électrique étant assurée par des microcations tels que K+, Ca2+, etc., aisément interchangeables, on explique ainsi l’emploi des zéolites comme adoucisseurs d’eaux naturelles.
R. D.
L. C. Pauling, The Nature of the Chemical Bond and the Structure of Molecules and Crystals (Ithaca, N. Y., 1939, 2e éd., 1944 ; trad. fr. la Nature de la liaison chimique et la structure des molécules et des cristaux, P. U. F., 1949). / B. Pullman, la Structure moléculaire (P. U. F., coll. « Que sais-je ? », 1953 ; 7e éd., 1973).





