dosage

Détermination de la concentration molaire d’un espèce chimique (molécule ou ion) dans une solution donnée.

Les dosages constituent une technique d’analyse courante en chimie, mais aussi en biologie, notamment pour l’analyse chimique du sang : dosage du cholestérol, de produits dopants, etc. (→ dosage biologique).
1. Les méthodes de dosage
Il existe deux types de dosage :
1.1. Les dosages non destructifs
Ils ne font pas intervenir de réactions chimiques. Le principe de ce type de dosage repose sur la variation de grandeurs physiques dont la valeur ne dépend que de la concentration de l’espèce en solution : variation de l’indice de réfraction, variation de l’absorbance (grandeur qui mesure la capacité d’un liquide à absorber une radiation lumineuse de longueur d’onde λ), variation de la conductance G.
Les dosages non destructifs les plus courants sont les dosages par étalonnage, c’est-à-dire des dosages qui utilisent des solutions dites étalons contenant l’espèce chimique à doser en différentes concentrations connues ; les solutions étalons permettent ainsi de tracer une courbe d’étalonnage à partir de laquelle on détermine la concentration inconnue recherchée.
1.2. Les dosages destructifs (ou directs)
Ils font intervenir une réaction chimique. On appelle alors ce type de dosages des titrages. L’espèce chimique dont on veut déterminer la concentration est appelée le réactif titré ; il est contenu dans la solution à titrer dans laquelle on verse une solution titrante qui contient un réactif titrant. D’un point de vue expérimental, le dispositif le plus simple d’un titrage se compose d’un bécher contenant la solution à titrer, d’un agitateur magnétique, et d’une burette graduée contenant la solution titrante.
Le choix des solutions utilisées pour les titrages est déterminé par les conditions suivantes :
• la réaction doit être univoque : les deux réactifs doivent réagir selon une seule et unique réaction ;
• la réaction doit être totale : l’un des deux réactifs doit disparaître complètement ;
• la fin de la réaction doit être marquée par un changement brusque d’une propriété physique observable ;
• la réaction doit être rapide (quelques secondes à quelques minutes).
À l'équivalence (moment où l'espèce chimique à titrer et l'espèce titrante ont été mélangées dans des proportions stœchiométriques), connaissant les volumes mis en jeu et la concentration de l'une des solutions, il est aisé de déterminer la concentration inconnue.
2. Exemples courants de dosages
2.1. Titrages acido-basiques
Les dosages les plus courants sont les titrages acido-basiques, dont le principe est le suivant :
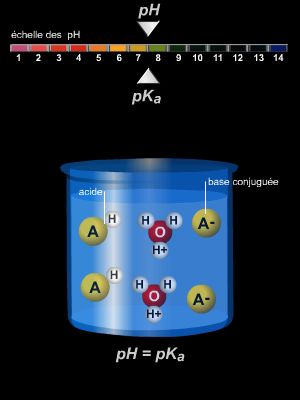
– on dispose d’une solution contenant un acide de concentration inconnue ;
– on y ajoute, goutte à goutte, une solution d’une base de concentration connue : il se produit une réaction de neutralisation entre l’acide de la première solution et la base de la solution ajoutée ;
– on mesure à chaque ajout le pH de la solution étudiée ;
– lorsque le pH devient neutre, la totalité de l’acide a été consommé par la base ;
– sachant quelle quantité de base a été versée pour obtenir la neutralisation, on en déduit la concentration en acide de la solution initiale.
De la même manière, pour déterminer la concentration en base d’une solution, on ajoutera une solution acide de concentration connue.
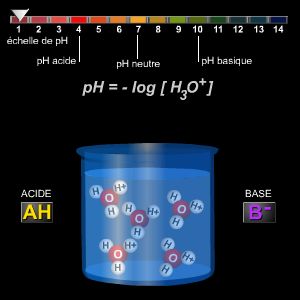
En pratique, on étudie la variation du pH de la solution à titrer en fonction du volume de solution versé, ce qui permet de tracer la courbe de titrage. L'équivalence acido-basique correspond au volume de la base (ou d’acide) qu'il est nécessaire d'ajouter pour consommer la totalité de l'acide (ou de la base). Ce point est caractérisé par une brusque variation de pH (appelée « saut de pH ») ; on le détermine expérimentalement à l'aide d'un pH-mètre ou d'un indicateur coloré.
On peut doser un acide fort par une base forte (ou l'inverse), un acide faible par une base faible (ou l'inverse), un acide faible par une base forte ou encore une base faible par un acide fort. Selon les cas, les équations régissant l'évolution du pH sont différentes. On peut également doser une solution contenant un polyacide (acide présentant plusieurs acidités, par exemple l’acide phosphorique H3PO4). Dans chacun de ces cas, la forme de la courbe de titrage est différente ; en particulier, dans le cas du dosage d’un polyacide par une base forte, la courbe présente plusieurs sauts à différentes valeurs du pH.
2.2. Titrage complexométrique
Les titrages complexométriques sont des dosages basés sur la formation de complexes (édifices chimiques formés généralement par l'association d’un ion métallique avec d’autres ions ou molécules appelées ligands ou coordinats). Dans le cas d’un titrage complexométrique, on peut également mesurer le pH de la solution : les réactions de complexation étant des réactions acido-basiques au sens de Lewis (selon Lewis, un acide est un composé capable d'accepter un doublet d'électrons et une base un composé capable de donner un doublet d'électrons).
Par ailleurs, la propriété étudiée peut être la coloration de la solution (par une méthode spectroscopique) ou la susceptibilité magnétique de la solution ; en effet, ces deux propriétés varient de manière très sensible entre le moment où l’ion métallique se trouve à l’état libre et à l’état complexé.
2.3. Titrages par précipitation
Les titrages par précipitation sont fondés sur la solubilité du produit de la réaction de titrage : lorsque la concentration du produit passe le seuil de solubilité, un précipité se forme. Celui-ci est détecté à l’œil nu.
Par exemple, lors du titrage d’une solution incolore de nitrate de plomb Pb(NO3)2 par une solution incolore d'iodure de potassium (KI), il se forme un précipité jaune d'iodure de plomb (PbI2).
2.4. Titrages rédox (ou d’oxydoréduction)
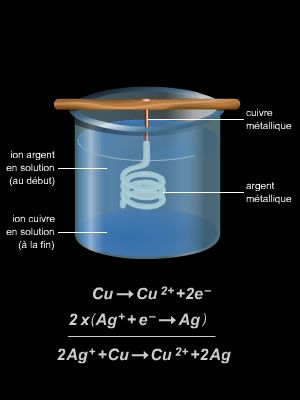
Les titrages rédox (ou d’oxydoréduction) sont des dosages dont la réaction support est une réaction d’oxydoréduction. Le principe d’un titrage rédox repose sur des mesures électrochimiques. En particulier, la propriété étudiée est souvent la conductivité électrique de la solution qui dépend du degré d’avancement de la réaction d’oxydoréduction.