électrochimie

Science et technique des transformations réciproques de l'énergie chimique et de l'énergie électrique.
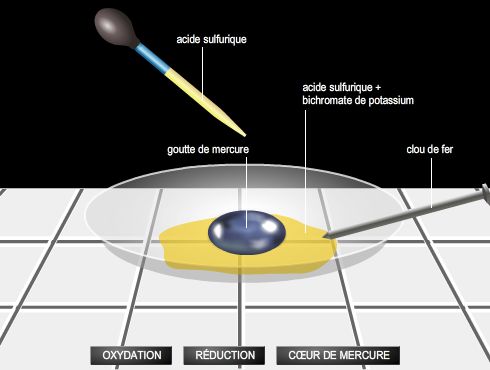
L’électrochimie analyse les liens qui existent entre la chimie et l’électricité. Elle constitue la base théorique des processus d’oxydoréduction, de corrosion et d’électrolyse. C’est encore actuellement un important sujet d’étude pour de nombreux chercheurs qui souhaitent en multiplier les applications. En effet, l’importance économique des procédés industriels dérivés est considérable : électrolyse des métaux (cuivre, aluminium, etc.), galvanoplastie, dorure, cuivrage, nickelage, électroaffinage (cuivre, zinc, etc.), protection contre la corrosion, etc.
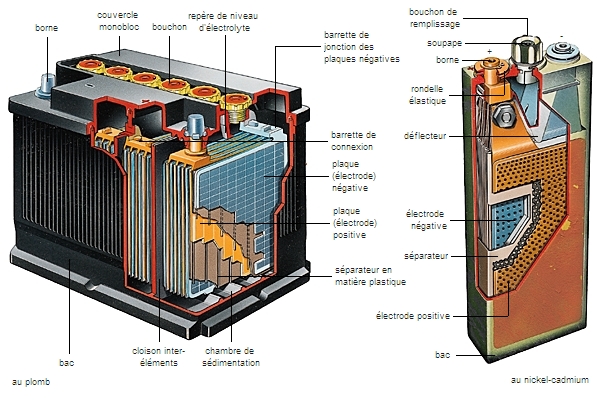
L’électrochimie semble appelée à jouer un rôle de plus en plus important dans la solution des problèmes liés à l’énergie et à la pollution : traitement des effluents industriels, développement de l’hydrométallurgie, conversion et stockage de l’énergie sous forme chimique, en particulier sous forme d’hydrogène.
1. Histoire de l'électrochimie

En 1791, Luigi Galvani montre que la contraction des membres inférieurs de la grenouille peut produire un courant électrique. Ce brillant physicien et médecin italien vient de mettre au jour l’une des facettes de l’électrochimie : la production d’énergie électrique à partir d’une réaction d’oxydoréduction spontanée.

Quelques années plus tard, en 1800, son compatriote Alessandro Volta interprète de manière rationnelle la découverte de Galvani en mettant au point la première pile électrique (pile voltaïque) et devient l’un des précurseurs de toute l’électrochimie.
En 1833, le physicien et chimiste britannique Michael Faraday formule les lois fondamentales de l’électrolyse, tandis que le chimiste suédois Svante Arrhenius énonce en 1884 sa théorie sur la dissociation électrolytique, marquant ainsi l’avènement de l’électrochimie moderne.
Des progrès considérables sont réalisés au début du xxe siècle, notamment grâce aux travaux du chimiste allemand Walther Nernst (théorie des potentiels électrochimiques), ainsi que de ceux du Néerlandais Petrus Debye et de l’Allemand Erich Hückel (théorie des solutions électrolytiques). La fin du xxe siècle est marquée par l’utilisation de nouveaux types d’électrodes (ultramicroélectrodes), qui permettent d’accéder notamment à une meilleure compréhension des réactions d’oxydoréduction ayant lieu à l’intérieur des tissus vivants.
2. Les principes de base de l'électrochimie
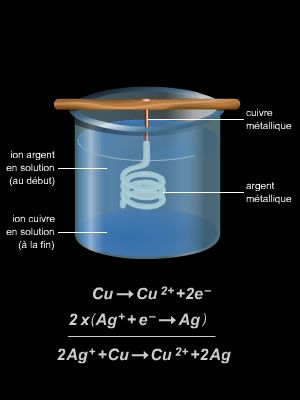
Dans une solution de sulfate de cuivre (Cu2+(aq) + SO42- (aq)), on plonge un morceau de métal de zinc (Zn(s)). Le métal se recouvre rapidement de cuivre métal. La réaction qui a lieu est la réaction spontanée suivante :
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Dans ce type de réaction, on indique l’état physique des différentes espèces chimiques entre parenthèses et en indice : solide (s), liquide (liq), gaz (g), solvaté (aq) – c’est-à-dire lié à des molécules d’eau. Par ailleurs, les ions SO42-(aq) n’interviennent pas dans la réaction : ils sont dits spectateurs.
Cette réaction s’accompagne d’un transfert d’électrons entre le cuivre et le zinc, mais cet échange d’électrons n’est pas utilisable puisqu’il se fait à l’intérieur du milieu réactionnel.
Pour mettre à profit cet échange d’électrons, il convient de conserver les réactifs et les produits à l’état séparé, ce qui est réalisé dans un dispositif, appelé cellule électrochimique. Cette séparation des réactifs et des produits constitue le principe de base de l’électrochimie.
3. Les cellules électrochimiques
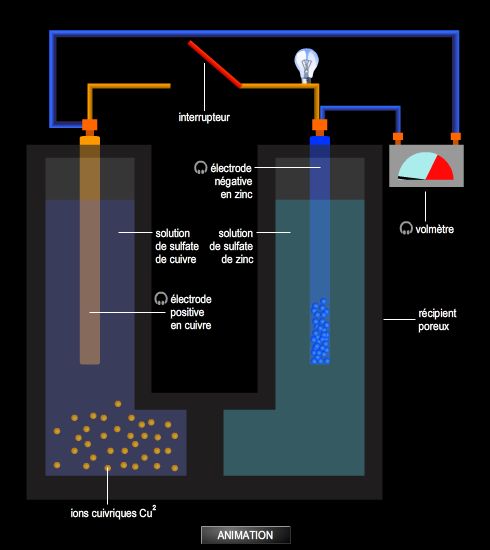
Une cellule électrochimique est constituée de l’association de deux demi-cellules, c’est-à-dire de deux récipients, chacun rempli d’un électrolyte (généralement une solution) et dans lequel plonge une électrode (souvent métallique). Ces deux demi-cellules peuvent être séparées par une paroi poreuse ou être totalement distinctes l’une de l’autre et reliées entre elles par un pont salin (tube contenant un électrolyte chimiquement inerte qui assure à la fois le passage du courant entre les deux demi-cellules et la neutralité électrique des deux solutions).
Pour schématiser une cellule, c’est-à-dire indiquer la nature des différents constituants de la cellule, on écrit la suite des conducteurs rencontrés lorsque l’on passe d’une électrode à l’autre en séparant d’un simple trait vertical les phases différentes et d’un trait double vertical, la séparation entre les électrolytes. Par exemple :
Zn(s)|ZnSO4(aq) || CuSO4(aq)|Cu(s)
4. Production de courant électrique dans une cellule électrochimique fonctionnant en pile
Dans la cellule notée Zn(s)|ZnSO4(aq) || CuSO4(aq)|Cu(s), la réaction spontanée qui a lieu est :
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Pour que les électrons puissent atteindre les ions Cu2+(aq), on relie entre elles les deux électrodes afin de permettre le déplacement des électrons à travers un circuit extérieur. Ces échanges électroniques s’accompagnent d’un déplacement d’ions, d’une solution électrolytique à l’autre, de manière à assurer la neutralité.
4.1. Pile électrochimique
Tant que les quantités des différentes espèces chimiques sont suffisantes, un courant est produit grâce à ce dispositif : la cellule ainsi décrite constitue une pile électrochimique.
4.2. Sens du courant dans une cellule électrochimique
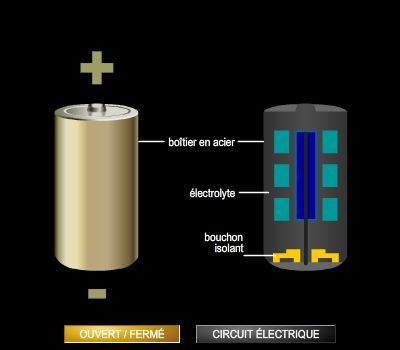
Lorsque la pile débite, c’est-à-dire lors de sa décharge, le sens du courant qui traverse le circuit peut être déterminé en étudiant le mouvement des électrons. Ceux-ci quittent la pile au niveau de l’électrode de zinc (électrode où a lieu l’oxydation, encore appelée anode), circulent à travers le circuit extérieur et arrivent à l’électrode de cuivre (électrode où a lieu la réduction ou cathode). Par conséquent, le courant se déplace de l’électrode de cuivre à l’électrode de zinc à l’extérieur de la cellule.
Lors de la décharge, la pile présente une polarité : l’électrode de zinc constitue le pôle − de cette pile et l’électrode de cuivre le pôle + ; les deux électrodes sont à des potentiels différents.
Dans les solutions électrolytiques ainsi que dans les éventuels ponts salins, le courant est véhiculé par les ions et non par les électrons.
Pour en savoir plus, voir l'article oxydoréduction, électrolyse.
5. Énergie fournie lors de la décharge d’une pile
Le courant produit lors de la décharge d’une pile constitue une source d’énergie qui peut être utilisée pour la réalisation d’un travail mécanique ou pour le chauffage d’un milieu quelconque (→ calorimétrie). Tout dépend de la quantité d’énergie susceptible d’être fournie par la pile, c’est-à-dire de la facilité avec laquelle les électrons peuvent traverser le circuit.
Cette énergie est d’autant plus importante que la différence de potentiel entre les deux électrodes est grande.
6. La thermodynamique de l’électrochimie
De façon générale, une pile fournit d’autant plus de courant et donc d’énergie que la réaction spontanée qui a lieu lors de sa décharge se fait plus facilement. Cette observation permet d’établir un lien entre la thermodynamique et l’électrochimie.
Si la pile Daniell (constituée des couples d’oxydoréduction Zn2+/Zn et Cu2+/Cu) fournit de l’énergie lors de sa décharge, c’est d’une part que l’enthalpie libre de la réaction Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s) est négative, et que d’autre part le potentiel de l’électrode de cuivre est supérieur à celui de l’électrode de zinc.
6.1. La force électromotrice d’une pile
La différence de potentiel entre les deux électrodes est également appelée force électromotrice (fem) de la pile ainsi constituée. Elle dépend de la contribution de chaque électrode : E = Ecathode – Eanode.
Elle dépend aussi de la concentration des espèces en solution.
6.2. Les potentiels d’électrode
Pour savoir comment une pile peut fonctionner, il faut connaître le potentiel associé à chaque électrode, c’est-à-dire à chaque couple d’oxydoréduction (ou couple redox).
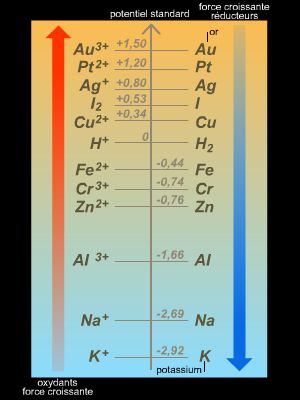
En pratique, seule une différence de potentiel peut être mesurée. Par conséquent, afin d’associer à chaque couple d’oxydoréduction une valeur de potentiel, il a été convenu de choisir comme électrode de référence l’électrode standard à hydrogène (ESH) et de lui attribuer un potentiel standard (c’est-à-dire lorsque tous les constituants sont dans leur état standard) E° = 0 V.
À tous les autres couples d’oxydoréduction, on associe une valeur de potentiel standard E° (relativement à la valeur associée à l’ESH).
→ électrode.
Ces potentiels permettent d’obtenir un classement des couples d’oxydoréduction et de prévoir le sens d’évolution d’une réaction chimique : l’oxydant du couple dont le potentiel E° est le plus élevé réagit avec le réducteur du couple dont le potentiel E° est le plus faible (dans les conditions standards).
Dès que l’on s’éloigne de ces conditions standards, il faut tenir compte notamment des activités des différentes espèces, ce que Walther Nernst a traduit par la formule suivante :
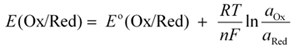
7. Prévision d’une réaction d’oxydoréduction
Pour savoir de quelle façon une pile peut fonctionner, il faut comparer les potentiels des couples en présence.
Par exemple, pour la pile Daniell :
• E°(Zn2+/Zn) = −0,76 V
• E°(Cu2+/Cu) = 0,34 V.
Dans les conditions standards, la réaction spontanée qui a lieu est donc bien :
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
La pile (supposée dans les conditions standards) fonctionne avec pour pôle + le pôle constitué de l’électrode de cuivre (oxydant le plus fort). Les électrons circulent donc de l’électrode de zinc (borne négative) vers l’électrode de cuivre (borne positive) à l’extérieur de la cellule – le sens du courant étant noté par convention dans le sens inverse à celui des électrons.
8. Applications de l'électrochimie
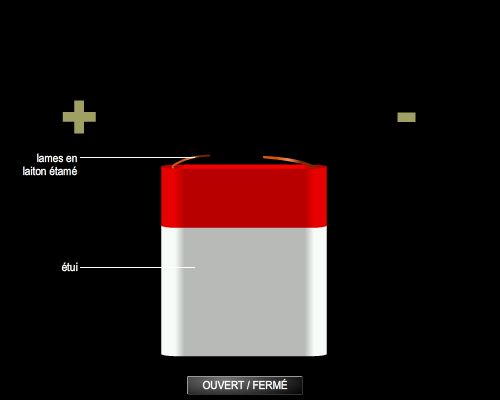
Les applications de l’électrochimie dans la vie quotidienne se résument principalement aux piles et accumulateurs. La pile Leclanché est une pile primaire, à usage unique, dont le potentiel à vide est de 1,5 V ; elle produit de l’électricité grâce à l’oxydation de son récipient en zinc et de la réduction du dioxyde de manganèse qui constitue sa cathode.
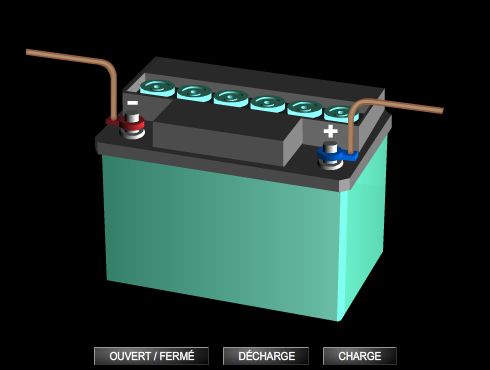
La batterie au plomb est quant à elle une pile secondaire, qui peut être chargée et déchargée ; elle est utilisée dans les automobiles.
Mais les domaines d’application de l’électrochimie sont extrêmement variés : préparations industrielles de gaz (Cl2, O2, H2, etc.), de la soude, de l’eau oxygénée par électrolyse de solutions aqueuses, électrométallurgie, protection contre la corrosion (protection cathodique, anodisation), dessalement de l’eau, synthèse de composés organiques et inorganiques (électrosynthèses), etc.
Située au carrefour de diverses industries, l’électrochimie constitue une branche de la chimie d’une grande vitalité.















