césium 137

Isotope radioactif du césium, noté 137Cs, dont le nombre de masse est égal à 137.
C’est un radio-isotope très connu, car il constitue la principale source de radioactivité des déchets des réacteurs nucléaires avec le strontium 90 et différents isotopes du plutonium (→ nucléaire).
1. Origine du césium 137
Le césium 137 n’existe pas à l’état naturel. Il est principalement produit lors de la fission de l’uranium dans les réacteurs nucléaires. Chaque réacteur à eau pressurisée conventionnel (REP) produit environ 24 kg de césium 137 par an.
De grandes quantités de césium 137 ont également été produites lors des nombreux essais nucléaires atmosphériques réalisés jusque dans les années 1990. Ce césium 137 s’est depuis déposé sur l’ensemble de la planète.
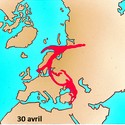
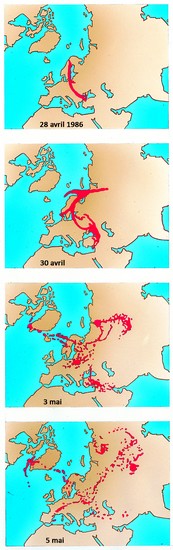
Par ailleurs, le césium 137 est également l’une des principales sources de contamination radioactive lors des accidents de réacteurs nucléaires, dont les plus connus sont ceux des centrales de Three Miles Island (États-Unis) en 1979, de Tchernobyl (Ukraine) en 1986 et de Fukushima (Japon) en 2011.
2. Propriétés du césium 137
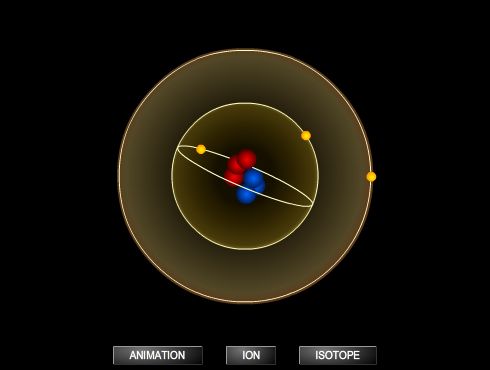
Comme tous les isotopes du césium (39 radio-isotopes au total), le noyau du césium 137 comporte 55 protons, mais il se distingue par son nombre de neutrons égal à 82. Son spin est de 7/2 et sa masse atomique est d’environ 136,907.
Le césium 137 se désintègre en baryum 137 (nucléide stable) selon le mode de désintégration β–, en émettant des rayons gamma de haute énergie (énergie de désintégration égale à 1,176 MeV) (→ élément, matière).
C’est un isotope radioactif dont la durée de vie est considérée comme moyenne. Sa période radioactive, ou temps de demi-vie (c’est-à-dire le temps au bout duquel la moitié des noyaux radioactifs, initialement présents, se sont désintégrés) est de 30,07 années.
3. Toxicité du césium 137
Du fait de ses émissions de rayonnement gamma, le césium 137 est extrêmement dangereux pour tous les êtres vivants (végétaux, animaux, hommes). De plus, sa toxicité est accrue par sa similarité chimique avec le potassium qu’il tend à remplacer dans les processus d’assimilation par les végétaux ou par ingestion dans l’organisme.
3.1. Effets du césium 137 sur la santé

On distingue généralement l’exposition externe et l’exposition interne au césium 137. Les contaminations cutanées sont difficiles à éliminer (la période au niveau de la peau étant d’environ quatre jours) et une dose locale élevée de césium 137 provoque une brûlure cutanée qui doit être traitée comme une brûlure classique (voir irradiation).
L’exposition interne est beaucoup plus dangereuse. En effet, s’il est inhalé ou ingéré, le césium 137 est assimilé comme son homologue et compétiteur naturel, le potassium, dans l’ensemble de l’organisme en se concentrant préférentiellement dans les muscles (avec une charge plus importante chez l’enfant que chez l’adulte). Sa période biologique (c’est-à-dire le temps au bout duquel la moitié du césium 37 qui a pénétré dans l’organisme est rejetée à l’extérieur dans les urines, les selles et la sueur) est de 100 jours environ.
L’ingestion de fortes doses de césium 137 a des effets dévastateurs : insuffisance médullaire, altération du système immunitaire et de la fonction de reproduction, affections rénales… Par ailleurs, à doses plus faibles et à plus long terme, le césium 137 entraîne une augmentation des cancers de la thyroïde, des malformations congénitales et fœtales, ainsi que des troubles neurologiques.
En termes de prise en charge thérapeutique des patients contaminés par le césium 137, le bleu de Prusse (ferrocyanure de fer) est le seul traitement efficace pour évacuer le césium 137 après ingestion.
3.2. Effets du césium 137 sur l’environnement
Dans l’environnement terrestre, le césium 137 reste concentré dans les couches supérieures du sol où il est fixé par les minéraux. Il est intercepté par le feuillage de la végétation et se retrouve ainsi dans la litière des forêts. Les champignons qui se développent en surface et à quelques centimètres sous la surface du sol, piègent le césium 137 (comme ils piègent, par ailleurs, les pesticides).
L’isotope radioactif peut ainsi se concentrer dans la chaîne alimentaire, notamment dans la chair du gibier (sangliers, etc.) ; mais il contamine tout aussi bien la chair des poissons du fait de sa présence dans des eaux courantes et les océans.
4. Utilisations industrielles et médicales
Dans les secteurs industriel et médical, le césium 137 est utilisé pour ses rayons gamma. Il est produit artificiellement par bombardement neutronique de césium stable (césium 133), puis est placé à l’intérieur d’une capsule scellée, où il est généralement mélangé avec une résine. L’activité de ces sources scellées de césium 137 peut varier de façon considérable (de 106 Bq à 1015 Bq).
La majeure partie de ces sources sont utilisées dans l’industrie dans les appareils de gammagraphie pour le contrôle non destructif de pièces métalliques, de soudures ou d’ouvrages d’art, ainsi que dans les irradiateurs industriels pour la stérilisation des aliments.
En médecine, on utilise des sources de césium 137 d’activités assez faibles (environ 109 Bq) dans le traitement de tumeurs cancéreuses, en plaçant la source directement au contact de la tumeur à traiter (brachythérapie, voir radiothérapie). Des sources d’activités plus élevées (de l’ordre de 1014 Bq ) sont utilisées pour l’irradiation de produits sanguins, permettant ainsi d’inhiber la division lymphocytaire afin d’éviter les risques de maladie post-transfusionnelle chez les patients immunodéprimés.