isomérie
Phénomène suivant lequel deux ou plusieurs corps présentent des propriétés différentes, bien qu’ils aient même composition élémentaire et même formule brute (Berzelius*, 1830).
Le fait qu’à un même élément correspondent souvent plusieurs corps simples d’aspects et de propriétés différents amena également Berzelius à créer (1840), pour désigner ce dernier phénomène, le terme d’allotropie. En outre, de nombreux corps, simples ou composés, présentent diverses variétés cristallines : on parle alors de « polymorphisme ». En fait, le domaine d’emploi actuel des termes précédents est assez imprécis : d’une part, le terme d’allotropie est parfois utilisé pour des composés ; d’autre part, certains exemples d’allotropie sont des cas de polymorphisme.
L’origine de tous ces phénomènes réside dans des différences, d’ailleurs assez variées, de structure chimique. Les corps purs sont, dans leur aspect macroscopique, la réunion de particules, atomes, molécules ou ions, suivant les cas. La possibilité de plusieurs arrangements réguliers, mais différents, de ces particules dans l’état solide cristallisé est à l’origine du polymorphisme. Dans de nombreux cas, cependant, les différences de structure se situent à l’intérieur même de la molécule ou d’un ion constituant nécessairement complexe ; là résident, à proprement parler, les cas d’isomérie. L’isomérie de structure moléculaire, rare en chimie minérale, est fréquente en chimie organique, où les composés moléculaires sont nombreux et les molécules parfois compliquées. À l’inverse, l’isomérie de structure ionique se rencontre surtout en chimie minérale, particulièrement dans les complexes :
• Il arrive que l’isomérie résulte d’un échange entre les deux ions du sel ; ainsi, le bromure de sulfatopentammine cobalt (III)
[Co(NH3)5SO4]+, Br–
et le sulfate de bromopentammine cobalt (III)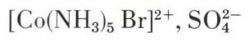
sont isomères ; dans le premier, l’ion sulfate est dissimulé à ses réactifs habituels et l’ion bromure ne l’est pas ; dans le second, c’est l’inverse.
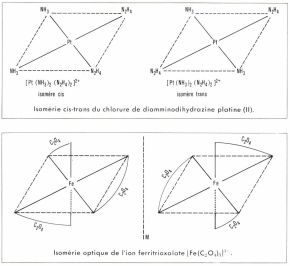
• On rencontre l’isomérie cis-trans (géométrique) dans les ions complexes, à structure plane carrée ou octaédrique, pour lesquels un même ligand, NH3 par exemple, peut se trouver en deux sommets contigus (isomère cis) ou non contigus (isomère trans). Il est évident qu’une telle isomérie ne peut exister dans les ions complexes à structure tétraédrique.
• L’isomérie optique est ainsi nommée parce que les isomères sont actifs à la lumière polarisée, dont ils font tourner d’un certain angle le plan de polarisation. Dans chaque isomère optique, la nature et la disposition des ligands sont telles que l’ion complexe n’est pas superposable à son image ; il en est ainsi par exemple pour l’ion ferritrioxalate [Fe(C2O4)3]3– : deux structures sont possibles, images l’une de l’autre, mais non superposables ; les isomères correspondants ont des pouvoirs rotatoires opposés ; ils constituent un couple d’inverses optiques ou énantiomorphes.
R. D.
isomorphisme
Propriété des corps présentant d’étroites analogies dans leurs formes cristallines.
Introduction
Dans un mémoire paru en 1819, le chimiste allemand Mitscherlich, étudiant les phosphates et les arséniates de potassium et d’ammonium, soulignait que ces sels, qui chimiquement sont analogues, se présentent en cristaux dont les formes cristallines sont identiques. Ayant étendu ces observations à des sulfates et à des carbonates, il introduisit une nouvelle propriété qu’il désigna sous le nom d’isomorphisme : des corps sont isomorphes quand, ayant des compositions chimiques analogues, ils ont les mêmes formes cristallines et sont susceptibles de se mélanger en proportions variables pour former un même cristal, dit solution solide ou cristal mixte. L’isomorphisme associe donc trois conditions, qui expriment une parenté étroite des propriétés physiques et chimiques de certains composés. Mais on en fit une loi, d’après laquelle deux corps qui satisfont à l’une des conditions précédentes remplissent par cela même les deux autres. Aussitôt de nombreuses difficultés se présentèrent ; on trouva des exemples de substances remplissant deux des conditions sans satisfaire à la troisième ; des discussions, parfois passionnées, autour de la notion d’isomorphisme animèrent le monde scientifique de la fin du siècle dernier et elles ont contribué au progrès d’un nouveau chapitre de la science, celui de la cristallochimie. L’isomorphisme eut les plus heureux résultats en chimie pour fixer les poids atomiques des éléments nouveaux ; ainsi, en 1828, le poids atomique du sélénium fut fixé en se fondant sur l’isomorphisme du séléniate et du sulfate de sodium ; celui du vanadium fut établi à partir des analogies cristallographiques de
l’apatite Ca5(PO4)3F,
la pyromorphite Pb5(PO4)3Cl,
la mimétite Pb5(AsO4)3Cl et
la vanadinite Pb5(VO4)3Cl.
La chimie inorganique, celle des composés métalliques montrent de nombreux exemples d’isomorphisme. Les composés naturels que sont les minéraux sont le plus souvent des cristaux mixtes. Citons, parmi de très nombreux exemples, les spinelles, dont certains sont des produits naturels et d’autres des composés que fabrique l’industrie pour leurs applications électriques et magnétiques ; leur formule générale est XY2O4 ; X2+ est un élément bivalent tel que Mg, Fe2+, Zn ; Y3+ un élément trivalent qui peut être Al, Fe3+, Cr,... Les carbonates rhomboédriques, de formule XCO3, avec X2+, qui est l’un des éléments bivalents Mg, Fe, Zn, Mn, forment une famille isomorphe. Les silicates forment presque toujours des groupes de composés isomorphes. C’est le cas des grenats X3Y2Si3O12, dans lesquels X2+ est l’un des éléments bivalents Ca, Mg, Fe, Mn et Y3+ un élément trivalent Al, Fe, Cr.
Signalons quelques-unes des difficultés à la loi de Mitscherlich, qui furent rapidement observées et qui proviennent de l’imprécision que comporte la notion d’analogie. Ainsi, le sulfure de plomb PbS et le sulfure d’argent Ag2S ne peuvent être considérés comme analogues du point de vue chimique ; cependant, tous les deux, cristallisant dans le système cubique, sont susceptibles de se mélanger pour cristalliser ; il en est de même pour l’albite NaAlSi3O8 et l’anorthite CaAl2Si2O8, toutes deux tricliniques avec les mêmes formes cristallines, qui syncristallisent en double proportion. Les composés ZnSnF6 . 6H2O, ZnNbOF5 . 6H2O, ZnMoO2F4 . 6H2O, de formules chimiques différentes, ont des formes cristallines voisines et sont syncristallisables.




