glucides (suite)
Désoxyoses
On connaît les 16 isomères des désoxy-6 aldohexoses ; le plus commun est le D-rhamnose,
extrait du fruit du Nerprun (Rhamnus).
Le plus important des désoxyoses est le désoxy-2-D-ribose :
Son rôle biologique est considérable (acide désoxyribonucléique).
Diholosides
Les diholosides résultent théoriquement de l’élimination d’une molécule d’eau entre deux oses sous forme cyclique. Cette déshydratation fait toujours appel à au moins l’un des hydroxyles hémiacétaliques. On représente schématiquement un diholoside en écrivant le nom des oses générateurs de part et d’autre du signe < >, dans lequel on fait figurer les numéros des carbones intéressés par l’anhydrisation, le carbone hémiacétalique étant numéroté 1 dans les aldoses, et 2 dans les cétoses.
D-galactopyrannose-β < 1-4 > D-glucopyrannose-α (D-lactose, ou sucre de lait.)
S’ils dérivent des aldoses, les diholosides numérotés < 1-1 > ne sont pas hydrolyses en milieu faiblement alcalin ; ils ne peuvent donc réduire le nitrate d’argent ammoniacal ; on les appelle osido-osides (ou diholosides non réducteurs). S’ils sont numérotés < 1-n > (n = 2, 3, 4 ou 6), ils gardent une fonction aldéhydique potentielle ; on les appelle osido-oses (ou diholosides réducteurs) ; c’est le cas du D-lactose.
S’ils dérivent d’un aldose et d’un cétose, c’est le diholoside < 1-2 >, qui est non réducteur ; c’est le cas du saccharose.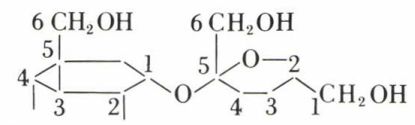
D-glucopyrannose-α < 1-2 > D-fructofurannose-α.
Le saccharose, ou sucre ordinaire, s’extrait de la Canne à sucre ou de la Betterave. Non réducteur, il le devient après hydrolyse acide, qui le transforme en un mélange équimolaire de D-glucose et de D-fructose, tous deux réducteurs. Dans cette hydrolyse, le pouvoir rotatoire spécifique passe de + 66° à – 20° ; c’est pourquoi on la désigne généralement par « inversion » du saccharose ; elle peut être réalisée à froid par des enzymes (invertase). L’invertase est une α-glucosidase qui hydrolyse tous les glucosides-α < 1-n >. D’autres enzymes sont également spécifiques. Les β-galactosidases (lactase) hydrolysent les galactosides-β < 1-n >, en particulier le D-lactose.
Polyosides
Les polyosides résultent de la condensation, généralement sur le mode répété < 1-4 >, d’un très grand nombre de molécules d’osés. Les plus connus sont l’amidon (D-glucoside indéfini-α < 1-4 >) et la cellulose (D-glucoside indéfini-β < 1-4 >). L’hydrolyse acide conduit, dans les deux cas, au D-glucose, mais l’hydrolyse enzymatique de l’amidon (amylase) engendre quantitativement un diholoside, le D-glucopyrannose-α < 1-4 > D-glucopyrannose, appelé maltose.
Hétérosides
Pour les biologistes, les hétérosides résultent de l’élimination de l’hydroxyle hémiacétalique d’un ose cyclique ou d’un diholoside réducteur avec un hydrogène lié à O, à S ou à N, d’où trois types ; les O-hétérosides, les S-hétérosides, les N-hétérosides. L’hydrolyse acide ou enzymatique libère un ou plusieurs oses et l’aglycone, qui peut être décomposé ; c’est ainsi que l’amygdaloside (O-hétéroside des amandes amères), D-glucopyrannose-β < 1-6 > D-glucopyrannose-β  est hydrolyse par l’émulsine (β-glucosidase) en deux molécules de D-glucose, acide cyanhydrique HCN et aldéhyde benzoïque Φ—CHO.
est hydrolyse par l’émulsine (β-glucosidase) en deux molécules de D-glucose, acide cyanhydrique HCN et aldéhyde benzoïque Φ—CHO.
Emil Fischer
Chimiste allemand (Euskirchen, Prusse-Rhénane, 1852 - Berlin 1919). Il détermina les formules stéréochimiques des glucides et montra l’action spécifique des ferments. Il reproduisit par synthèse un grand nombre doses. Prix Nobel de chimie pour 1902.
C. P.
M. Mascré, « Éléments de phytochimie », dans E. Perrot, Matières premières usuelles du règne végétal, t. I (Masson, 1943). / R. D. Guthrie et J. Honeyman, Introduction to Chemistry of Carbohydrates (Oxford, 1960 ; 3e éd., 1968 ; trad. fr. Introduction à la chimie des glucides, Dunod, 1968). / Biochimie des glucides, structure, spécificité (C. N. R. S., 1961). / J. J. Bernier et J. Paupe, Glucides (Masson, 1963).
Les glucides végétaux et animaux et leurs rôles en biologie et en médecine
Les glucides sont abondamment répandus dans la nature. Ils sont présents chez les végétaux, les Bactéries et les animaux ; ils constituent des substances énergétiques, des substances de réserve, des substances de soutien. Les organismes vivants sont capables de les synthétiser et de les dégrader, grâce à de nombreuses réactions enzymatiques. On trouve, en outre, de nombreux glucides dans les produits des métabolismes bactériens.
Glucides végétaux
On les obtient par des méthodes extractives, principalement la chromatographie sur colonne d’absorbants divers (cellulose, charbons actifs...), et l’usage de solvants appropriés. On trouve chez les végétaux toutes les classes de glucides : oses et osides (holosides et hétérosides), les formes les plus simples préexistant rarement, mais résultant le plus souvent de la dégradation de molécules plus complexes au cours de la dessiccation ou au cours de l’extraction.
Les principaux oses et holosides simples ainsi rencontrés sont les suivants.
Oses
• Pentoses :
arabinose des arabanes ;
xylose des galactanes ;
rhamnose des hétérosides des Rhamnacées (Nerprun) ;
digitalose des hétérosides des Digitales, apiose du Persil ;
• hexoses :
glucose, le plus répandu, le plus souvent associé au fructose, ou lévulose ;
galactose des galactanes ;
mannose des mannanes ;
sorbose du Sorbier, dérivant du sorbitol, hamamélose de l’Hamamélis.
Osides
• Diholosides :
tréhalose des Champignons ;
gentiobiose de la Gentiane ;
saccharose de la Betterave et de la Canne à sucre ;
rutinose du rutoside (rutine) ;
scillabiose de la Scille ;
• triholosides :
médézitose de la manne de Briançon ;
gentianose de la racine fraîche de Gentiane ;
raffinose de la Betterave et des Légumineuses ;
• tétraholosides :
stachyose de la manne de Frêne et des Légumineuses ;
lychnose des Caryophyllées ;
• pentaholosides :
verbascose du Bouillon blanc.




