émission (suite)
D’après une loi énoncée par G. G. Stokes (1819-1903), les longueurs d’onde λ réémises devraient être toutes plus grandes que la longueur d’onde λe du flux excitateur. Cette loi n’est pas toujours vérifiée : le spectre de fluorescence peut parfois contenir des radiations de longueurs d’onde λ inférieures à λe. Ainsi, sur la figure 2, les spectres d’excitation E et de fluorescence P de la fluorescéine empiètent l’un sur l’autre : on voit que λe = 0,54 μ peut produire la réémission de longueurs d’onde inférieures (λ = 0,53 μ par exemple). Toutefois, le maximum de P correspond toujours à une longueur d’onde plus grande que celle du maximum de la courbe d’absorption E.
Théorie simplifiée de l’émission
Si, dans un atome, un électron passe d’un niveau excité W1 à un niveau inférieur W0, il y a émission d’une radiation de fréquence ν10 telle que
h ν10 = W1 – W0,
h étant la constante de Planck.
Dans un atome, il y a différents niveaux d’excitation correspondant aux diverses couches électroniques. À chaque passage d’un niveau à l’autre (inférieur) correspond l’émission d’une radiation monochromatique (fig. 3).
Dans le cas d’une molécule, le passage d’un état excité au niveau fondamental donne une infinité de raies (bandes), car aux variations d’énergie des atomes s’ajoutent les variations quantifiées, d’une part, de l’énergie des noyaux oscillant autour de leur position d’équilibre et, d’autre part, de l’énergie de rotation de l’ensemble de la molécule.
• L’atome ou la molécule ne peuvent se trouver dans un état excité qu’en ayant reçu de l’énergie. Celle-ci est due à un choc avec un corpuscule.
Les corpuscules tels que les atomes, les ions ou les électrons en mouvement possèdent avant le choc une énergie cinétique Ec variable avec leur vitesse. Pendant le choc, ils cèdent à l’atome une partie E de cette énergie, qui correspond par exemple au passage de l’état normal W0 à l’état excité W1. (Dans ce cas, E = W1 – W0.) Après le choc, il leur reste l’énergie Ec – E.
Par contre, si le corpuscule est un photon de fréquence ν, son énergie hν est toujours complètement absorbée par l’atome ou la molécule, qui ne peuvent donc absorber que des photons dont l’énergie est exactement égale à celle qui leur est nécessaire pour atteindre un niveau excité.
• Utilisons les résultats précédents pour interpréter l’électroluminescence. Si on applique entre les électrodes une différence de potentiel V, un électron ainsi accéléré acquiert une énergie cinétique Ec = eV, qu’il peut céder par choc à un atome qui passera du niveau fondamental à un niveau excité. Par exemple, la vapeur monoatomique de mercure peut émettre une radiation de longueur d’onde λ = 0,253 7 μ, ce qui correspond à une transition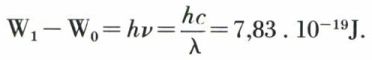
Il faut donc, pour exciter l’atome, appliquer une tension telle que
soit
Pour interpréter la fluorescence, utilisons le schéma des niveaux d’énergie, par exemple d’une molécule diatomique (fig. 4), et considérons l’état électronique fondamental F et l’état excité E. Chacun de ces états est multiple, car, comme nous l’avons signalé, il faut ajouter aux énergies électroniques les énergies de vibration de la molécule, que nous notons V0, V1... dans l’état F et V′0, V′1... dans l’état E.
À la température ordinaire, cette molécule se trouve dans l’état fondamental F et dans le niveau de vibration le plus bas V0. L’absorption de la radiation excitatrice l’amène au niveau excité E et, par exemple, au niveau de vibration V′2. Le retour de ce niveau à l’un des niveaux de l’état F compris entre V0 et V3 s’accompagne de l’émission du spectre de fluorescence (fig. 4a). Avant de retomber dans l’état F, la molécule peut aussi, par choc dû à l’agitation thermique, perdre de l’énergie de vibration et se trouve dans l’état V′1 (fig. 4b) ; les radiations émises correspondront alors aux transitions de V′1 à V0, V1, ou V2.
Si l’énergie d’agitation thermique est grande, les molécules pourront, au contraire, passer de V′2 à V′3 avant de retomber sur l’un des niveaux V0, V1, ou V2 (fig. 4c). Dans ce cas, la radiation émise a une longueur d’onde plus courte que celle de la lumière excitatrice. Cela explique les exceptions à la loi de Stokes.
James Franck et Gustav Hertz
James Franck, physicien allemand, naturalisé américain (Hambourg 1882 - Göttingen 1964). Il confirma, grâce à une étude de la conductibilité des gaz, la théorie de Bohr*, puis découvrit, avec le physicien allemand Gustav Hertz (Hambourg 1887 - Berlin-Est 1975), le mécanisme des phénomènes de luminescence. Tous deux définirent en 1913 les niveaux d’énergie des électrons de l’atome et partagèrent le prix Nobel de physique en 1925.
C. I.
M. Curie, Fluorescence et phosphorescence (Hermann, 1946 ; nouv. éd., 1954). / P. Bricout, Ondes et électrons (A. Colin, 1953). / R. Bernard, la Luminescence (P. U. F., coll. « Que sais-je ? », 1961). / G. Monod-Herzen, Luminescence (Dunod, 1965).





