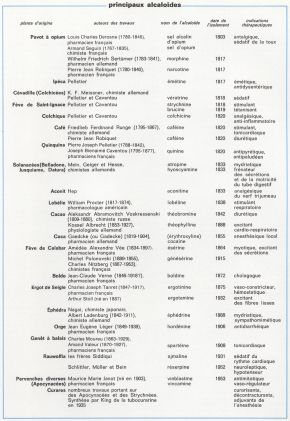
alcaloïdes
Substances organiques alcalines extraites de certains végétaux.
Derosne, en 1803, puis Seguin. en 1804, isolèrent de l’opium une substance basique qu’ils nommèrent sel d’opium ; la nature alcaline de ce corps fut contestée et attribuée à la potasse utilisée pour sa préparation, car tous les principes végétaux jusqu’alors isolés étaient acides. En 1817, le Hanovrien Sertürner, reprenant les travaux de Derosne et de Seguin, aboutit au même « sel d’opium », qu’il nomma morphine et dont, dès lors, le caractère alcalin ne devait plus être contesté. La morphine est ainsi le premier corps connu d’une longue série de composés qu’à partir de 1818 on désignera sous le nom d’alcaloïdes. On en connaît aujourd’hui plusieurs centaines grâce à un grand nombre de recherches poursuivies depuis le début du xixe s, jusqu’à nos jours. Souvent très différents en apparence les uns des autres, les alcaloïdes possèdent en commun un certain nombre de caractères physiques et chimiques. Rarement liquides (nicotine, canine, spartéine, pelletiérine, pilocarpine), ils sont en général cristallins, insolubles dans l’eau et donnent avec les acides des sels solubles : c’est d’ailleurs sous forme de sels organiques qu’on les rencontre dans la nature. Ils se comportent comme des bases plus ou moins fortes en raison de la présence, dans leur molécule, d’un atome d’azote salifiable sous forme d’aminé primaire, secondaire, tertiaire ou d’ammonium quaternaire ; ce groupement aminé est lui-même rattaché à un ensemble hétérocyclique variable (pyrrol, indol, quinoléine, phénanthrène, glyoxaline). Les alcaloïdes donnent des réactions comparables avec un certain nombre de réactifs généraux et sont en général solubles dans les solvants organiques ; on les rencontre rarement seuls dans une même plante, mais mêlés à d’autres alcaloïdes de propriétés voisines. Ils sont en général amers et toxiques. L’action de l’oxygène sur le groupement aminé de certains alcaloïdes détermine la formation d’un aminoxyde d’alcaloïde, ou génalcaloïde (M. Polonovski, 1925) ; on rencontre parfois les génalcaloïdes dans la nature (génésérine de la fève de Calabar), mais ceux-ci sont le plus souvent préparés par oxydation de l’alcaloïde correspondant, dont ils ont les mêmes propriétés pharmacologiques ; leur toxicité est toutefois très atténuée, car ils n’agissent que progressivement, étant libérés dans l’organisme après réduction, à la façon d’un médicament retard. Les alcaloïdes sont préparés par broyage de la plante avec une base minérale forte ; la base organique ainsi déplacée est purifiée soit par distillation lorsqu’elle est volatile et entraînable par la vapeur d’eau (nicotine), soit par reprises et cristallisations successives dans des solvants appropriés. La synthèse de beaucoup d’alcaloïdes a été réalisée au laboratoire, mais l’industrie n’utilise que rarement ce procédé, pour des raisons économiques ; par contre, de nombreuses techniques permettent, par hémisynthèse, la préparation d’alcaloïdes à partir de corps voisins. La plupart des alcaloïdes ont reçu des applications thérapeutiques.
R. D.
Pharmacopée française (toutes éditions, depuis 1815). / P. Lebeau et G. Courtois, Traité de pharmacie chimique (Masson, 1929 ; 2 vol.). / E. Perrot, Matières premières usuelles du règne végétal (Masson, 1943-1944 ; 2 vol.). / R. Hazard, Précis de thérapeutique et de pharmacologie (Masson, 1953). / J. Leclerc (sous la dir. de), Formulaire pharmaceutique (Vigot Frères, 1965).
alcanes
Hydrocarbures saturés acycliques.
Le plus simple est le méthane CH4. Les autres s’en déduisent par des substitutions répétées du groupe CH3 à l’un des atomes d’hydrogène d’un alcane plus simple. Les alcanes peuvent être linéaires (ou normaux), comme CH3—(CH2)n – 2—CH3, ou ramifiés, tel
(CH3)2CH—CH2—C(CH3)3.
Les alcanes normaux ont un nom officiel formé du préfixe grec précisant le nombre d’atomes de carbone, suivi de la désinence ane :
CH3—(CH2)4—CH3 = hexane.
Toutefois, les quatre premiers termes ont des noms particuliers : méthane, éthane, propane, butane.
Les alcanes ramifiés sont considérés comme résultant de la substitution dans le carbure normal correspondant à la chaîne linéaire la plus longue que l’on puisse trouver dans leur formule ; ils en portent le nom, précédé de ceux des radicaux substituants. Ceux-ci portent le nom de l’alcane qu’ils formeraient en se soudant à l’hydrogène, dans lequel la désinence ane a fait place à la désinence yle. Un numérotage est parfois nécessaire ; il est choisi de façon à donner à la somme des numéros la valeur minimale ; un exemple illustre cette nomenclature :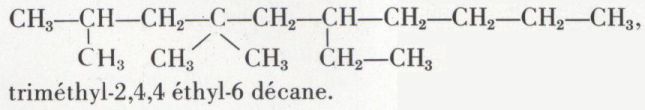
Cette nomenclature sert de base à celle de tous les composés organiques.
Les alcanes sont abondants dans les pétroles naturels, dont ils forment la majorité et parfois la quasi-totalité. Autrefois employés seulement comme source d’énergie, de chaleur ou de lumière, les pétroles sont devenus récemment le point de départ d’une part fondamentale de la synthèse organique.
Toutefois, si l’analyse immédiate permet d’en extraire les premiers termes, la complexité des pétroles naturels est telle qu’il est difficile d’en tirer les termes moyens, qu’une distillation serrée ne sépare qu’imparfaitement.
Le craquage hydrogénant des pétroles lourds est une source d’alcanes plus légers. La recombinaison des alcanes et des alcènes provenant du craquage simple (reformage) conduit à des alcanes plus ramifiés que les alcanes naturels et présentant de meilleures qualités comme carburants.
Il s’ensuit que l’obtention d’un alcane défini un peu lourd exige des méthodes synthétiques.
Préparations
Parmi celles-ci, nous citerons tout d’abord la réduction de composés organiques plus complexes, mais plus faciles à obtenir exempts d’isomères ou d’homologues : hydrogénation catalytique, sur nickel ou platine, des alcènes ou des alcynes ; réduction des fonctions oxygénées (alcools, aldéhydes ou cétones) par la méthode d’hydrogénation de Berthelot (chauffage en tube scellé avec l’acide iodhydrique aqueux et le phosphore rouge) ; réduction des éthers halohydriques, qui peut se faire dans les conditions les plus diverses, mais plus commodément par l’intermédiaire de l’organomagnésien :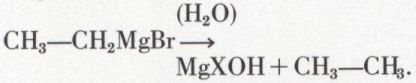
Parmi les réactions synthétiques, la plus simple est la réaction de Wurtz :
dont on peut rapprocher la duplication du radical R lors de l’électrolyse du sel de sodium R—CO2Na :
Enfin, quelques dégradations engendrent des alcanes. C’est le cas de la décarboxylation des acides :
en pratique,